Этиотропная терапия острых кишечных инфекций
Доступность статистической информации о заболеваемости острыми кишечными инфекциями (ОКИ) в Российской Федерации не улучшается. Сложности в получении объективной информации о фактической этиологической структуре ОКИ ведут к тому, что практические врачи ориентируются в большинстве случаев на собственный опыт и региональные данные. Активное внедрение в практическую деятельность стационаров страховой медицины требует максимального снижения стоимости обследования и лечения пациентов и, как следствие, ведет к упрощению диагностики, зачастую в ущерб ее качеству, а также применению препаратов преимущественно отечественного производства.
Ежегодно в США патогенные микроорганизмы, передающиеся пищевым путем, вызывают около 76 млн случаев кишечных инфекций, в том числе 325 000 больных госпитализируется и 5 000 умирает. Только число случаев шигеллеза по оценкам экспертов составляет около 450 000, из них около 6 000 госпитализируется; а инфекции, вызванной норовирусами, — около 23 млн., из которых почти 40% связано с пищевым путем передачи. Число же официально регистрируемых случаев ОКИ в Российской Федерации в десятки раз меньше и не превышает 700 000 в год.
Немаловажной проблемой диагностики кишечных инфекций является формальный подход не только к назначению диагностических исследований, но и к оценке их результатов. Так, например, проведенный нами анализ 1522 историй болезни пациентов гражданских и военных стационаров, перенесших ОКИ в 2003–2006 гг., показал, что при поступлении их в стационар осмотр стула не проводился или данные о результатах осмотра отсутствуют в 31,4% историй болезни при легком течении заболевания, 16,6% — средней степени тяжести и 42,7% при тяжелом течении. Отсутствие патологических примесей в испражнениях отмечено у 32,8% больных с легким течением кишечной инфекции, 21,9% — среднетяжелым и даже у 6,1% — тяжелым.
Копрологические исследования чаще всего не проводятся при тяжелом течении болезни — 36,14%, в то время как при легком течении и средней степени тяжести болезни таких случаев было достоверно меньше — 11,06% и 5,78% соответственно (p > 0,001). При копрологическом исследовании патологических изменений в копрограмме не обнаружено в среднем у 29,83% больных при легкой степени тяжести кишечной инфекции, 11,02% — средней и 7,84% тяжелой. В то же время, несмотря на выявление копрологических признаков колита у 13,6% пациентов с острым гастроэнтеритом и у 25,5% острым энтеритом, изменения в окончательный диагноз внесены не были. А в тех случаях, когда в диагнозе отмечено наличие колита, копрологические признаки отсутствовали у 50,6% больных острым гастроэнтероколитом 46,1% — острым энтероколитом.
Диагностические посевы испражнений выполнялись у 49,0% пациентов двукратно, 23,5% — трехкратно и 17,0% — однократно. С увеличением степени тяжести эпизода ОКИ увеличивалась доля пациентов, у которых диагностические исследования проводились однократно. Так, при легком течении заболевания в 57,5% случаев выполнены три и более диагностических посева испражнений для выявления патогенной микрофлоры и всего лишь в 18,8% случаев исследования выполнялись однократно. При средней степени тяжести инфекции трехкратные посевы проведены в 19,9%, а однократные — в 15,6% случаев, в то время как у 64,5% больных выполнено два посева. При тяжелом течении заболевания в 44,4% случаев микробиологические исследования выполнены лишь один раз. Вместе с тем серологические исследования с целью установления этиологии заболевания проводятся чаще при тяжелом течении болезни — 58,54%, чем при среднетяжелом — 25,2% и легком — 19,22% (p < 0,001). В абсолютном большинстве случаев диагностические серологические тесты выполняются однократно — 70,9%. Несмотря на то, что чаще всего этот вид обследования назначается при тяжелом течении заболевания, именно в этих случаях у 85,1% больных исследования проводятся однократно.
Дополнительные микробиологические исследования для выявления этиологического агента данного эпизода диареи проводились у небольшого числа пациентов. Так, посев кала для выявления иерсиний (Yersinia enterocolitica и Y. pseudotuberculosis) выполнен у 2,3% обследованных больных, посевы крови — у 15,1%, желчи — 0,1%, рвотных масс — 0,5%. Исследование кала на ротавирусы проведено у 21,0% пациентов, исследование кала на дисбактериоз — 1,0%.
Абсолютное большинство больных ОКИ получают антибактериальные препараты: так, при легком течении заболевания этиотропная терапия проводилась у 84,9% пациентов, среднетяжелом — 90,8% и тяжелом — 93,9%, только один антибиотик получали 54,7% пациентов. Чем тяжелее протекало заболевание, тем реже этиотропное лечение проводилось в режиме монотерапии — 70,6% при легкой степени тяжести, средней — 68,6% и тяжелой — 29,1%. При этом в военных стационарах монотерапия проводилась почти в два раза чаще, чем в гражданских, — 72,8% против 42,3%.
Чаще всего при ОКИ назначались фторхинолоны — 56,5% от всех назначений антимикробных средств, в том числе ципрофлоксацин — 44,7%, офлоксацин — 8,7% и норфлоксацин — 3,1%. Продолжают применять аминогликозиды: так, 22,3% всех назначений составил гентамицин; доля нитрофуранов не превышает 10% — фуразолидона — 4,7%, Фталазола — 2,9% и Фурадонина — 1,8%, а доля хлорамфеникола составила 3,4%. Повторные курсы этиотропной терапии назначались чаще всего при тяжелом течении инфекции — 15,9% и существенно реже при легкой — 3,7% (p < 0,001) и средней степени тяжести — 6,2% (p < 0,01).
Проведенный опрос врачей позволил установить, что основными критериями выбора антимикробных средств при ОКИ являются действие на основных возбудителей (35,7% ответов), хорошая переносимость (22,7%) и проникновение в кишечник (20,9%). Препаратами выбора для лечения острой дизентерии по мнению опрошенных являются ципрофлоксацин (31,3% ответов), фуразолидон (25,3%), гентамицин (12,6%) и нифуроксазид (9,5%). А в качестве препаратов выбора для лечения сальмонеллеза названы ципрофлоксацин — 31,5%, гентамицин — 15,8%, фуразолидон — 11,3% и хлорамфеникол — 11,1%. Препаратами выбора для лечения ОКИ неустановленной этиологии по мнению опрошенных специалистов являются нитрофураны (32,4%), фторхинолоны (28,3%) и существенно реже назывались аминогликозиды (11,9%). Цефтриаксон при ОКИ респонденты выбирали в 3,9–5,6% случаев.
В случае установления этиологии эпизода ОКИ трудностей с выбором этиотропной терапии в большинстве случаев не возникает. При острой дизентерии и сальмонеллезе выбор более чем в половине случаев осуществляют в пользу фторхинолонов. Однако в Российской Федерации доля случаев ОКИ установленной этиологии составляла в 2007 году 34,19%. В свободном доступе имеется информация о заболеваемости по следующим группам; брюшной тиф и другие сальмонеллезные инфекции; бактериальная дизентерия (шигеллез); энтеровирусные инфекции, псевдотуберкулез, ОКИ, вызванные установленными бактериальными, вирусными возбудителями, а также пищевые токсикоинфекции установленной этиологии; ОКИ, вызванные неустановленными инфекционными возбудителями, пищевые токсикоинфекции неустановленной этиологии.
С какими же еще микроорганизмами и простейшими могут быть связаны эпизоды кишечной инфекции? Так, например, в США около 50% пищевых вспышек острого гастроэнтерита связаны с норовирусами, ежегодно регистрируются случаи других вирусных инфекций, в том числе ротавирусной, астровирусной и др., а также заболевания, вызванные патогенными эшерихиями, кампилобактерами, листериями, криптоспоридиями, циклоспорами и др. К сожалению, в Российской Федерации получить информацию по ряду возбудителей не представляется возможным.
С точки зрения необходимости проведения этиотропной терапии и выбора конкретного этиотропного средства наибольший интерес представляет группа ОКИ неуточненной природы, протекающих с картиной поражения тонкой и одновременно толстой кишки — чаще всего это острый гастроэнтероколит и острый энтероколит. В связи с возможной бактериальной этиологией таких случаев актуальным становится определение возможного перечня антимикробных средств, активных в отношении прежде всего грамотрицательных микроорганизмов. Помимо фторхинолонов в эту группу входят цефалоспорины III поколения, прежде всего цефтриаксон, а также макролиды (азитромицин, эритромицин). В России активно применяются препараты нитрофуранового ряда, хотя в зарубежных рекомендациях кроме ко-тримоксазола другие средства не рекомендуются.
Сомнений в целесообразности выбора фторхинолонов в такой ситуации нет, но выбор альтернативного средства представляет определенные трудности. В таких случаях требуется, с одной стороны, широкий спектр активности препарата при достаточной безопасности его применения. С другой стороны, при отсутствии транслокации возбудителя из кишечника в абсолютном большинстве случаев целесообразно применение препаратов с преимущественно местным характером действия, т. е. плохо всасывающихся или невсасывающихся.
Среди невсасывающихся в желудочно-кишечном тракте антимикробных препаратов наиболее известны ванкомицин, неомицин, полимиксин М и нифуроксазид. К замедленно всасывающимся относятся тетрациклины (хлортетрациклин) и хлорамфеникол; к ограниченно всасывающимся — ампициллин. Высокие концентрации антибиотика в кишечнике могут создаваться за счет секреции с желчью и/или желудочным соком, к таким средствам относятся фторхинолоны (норфлоксацин, ципрофлоксацин), нитрофураны (фуразолидон), тетрациклины (доксициклин) и метронидазол. В связи с высоким уровнем резистентности микрофлоры, низким уровнем безопасности и высокой частотой нежелательных лекарственных реакций и взаимодействий неомицин, полимиксин М, хлортетрациклин и доксициклин, а также левомицетин и ампициллин при ОКИ имеют лишь исторический интерес. Ванкомицин и метронидазол имеют ограниченное применение — преимущественно для лечения Clostridium difficile — ассоциированных заболеваний.
Фуразолидон продолжают применять при лечении кишечных инфекции и в настоящее время, хотя он и обладает достаточно узким спектром безопасности и почти полностью метаболизируется в печени, создавая дополнительную нагрузку на детоксицирующие системы. Более безопасными являются новые нитрофураны — нифурател (Макмирор) и нифуроксазид (Эрсефурил, Энтерофурил). Первый после приема быстро абсорбируется из ЖКТ и также подвергается биотрансформации в печени и в мышечной ткани, полностью выводится с мочой (30–50% в неизмененном виде). Нифуроксазид практически не всасывается, менее токсичен по сравнению с фуразолидоном и создает более высокие концентрации в кишечнике. Вместе с тем ряд фармакокинетических параметров для нитрофуранов изучен недостаточно, в том числе вопросы проникновения через гистогематические барьеры, в частности через плацентарный барьер и т. д. (Падейская Е. Н., 2004).
Возможной альтернативой фторхинолонам при неинвазивных диареях может рассматриваться новый для отечественного рынка препарат — рифаксимин (Альфа Нормикс), являющийся полусинтетическим производным рифамицина SV. Фармакокинетические исследования рифаксимина выполнены на здоровых добровольцах (Descombe J. J. et al., 1994; Исследование FDA, 2004), а также на пациентах с язвенным колитом (Rizzello F. et al., 1998; Gionchetti P. et al., 1999), пациентах с печеночной энцефалопатией (Исследование FDA, 2004) и при экспериментально индуцированном шигеллезе (Taylor D. N. et al., 2003; Исследование FDA, 2004). Так, установлено, что при оральном приеме 400 мг рифаксимина натощак здоровыми волонтерами концентрация препарата в крови была ниже минимального определяемого предела 2,5 нг/мл в 50% случаев. Пиковые концентрации рифаксимина в плазме после 3-й и 9-й последовательных доз при экспериментальном шигеллезе составляли 0,81–3,4 нг/мл в первый день и 0,68–2,26 нг/мл на третий. При язвенном колите назначение рифаксимина в дозе 400 мг приводило к выделению с мочой около 0,009% полученной дозы, т. е. практически того же количества, что и у здоровых добровольцев.
Немаловажным является тот факт, что при применении в стандартных суточных дозах концентрация препарата в кале составляет 4000–8000 мкг/г, что в 160–250 раз превышает МПК90 для различных бактериальных энтеропатогенных агентов. Благодаря столь высоким концентрациям препарат эффективно подавляет жизнедеятельность таких аэробных бактерий, как Escherichia coli, Shigella spp., Salmonella spp., Yersinia enterocolica, Proteus spp., Vibrio cholerae, а также анаэробов — Clostridium perfrigens, C. difficile, Peptococcus spp., Peptostreptococcus spp., Bacteroides fragilis, Bacteroides spp. и Helicobacter pylori.
Как и другие представители семейства рифамицина, рифаксимин является специфическим ингибитором РНК-синтетазы путем подавления бета-подгруппы ДНК-зависимой РНК-полимеразы за счет нарушения обмена ионов магния. Формирование резистентности к рифаксимину связано с хромосомными изменениями, в отличие от плазмидно-опосредованной устойчивости к аминогликозидам (неомицин или бацитрацин). Частота подобных мутаций выше у грамположительных кокков, чем у грамотрицательных энтеробактерий. В отличие от плазмидного механизма формирования резистентности хромосомный характер устойчивости микрофлоры к рифаксимину имеет меньшую частоту возникновения и ведет к формированию менее жизнеспособных штаммов, самостоятельно элиминирующихся из кишечника в течение нескольких недель после завершения приема препарата. Кроме того, в исследованиях DuPont H.L. и Jiang Z.D.было показано, что грамположительные (в частности, энтерококки) и грамотрицательные (например, E. coli) микроорганизмы при коротких курсах терапии — 3–5 дней — не изменяют чувствительность к рифаксимину.
Низкие сывороточные концентрации рифаксимина обеспечивают минимальное влияние на механизмы метаболизма ксенобиотиков, но, помимо этого, Альфа Нормикс не подавляет человеческие печеночные изоферменты цитохрома Р450, 1A2, 2A6, 2B6, 2C9, 2C19, 2D6, 2E1 и 3A4 и, кроме того, имеет структурное сходство с лигандами, активирующими pregnane X receptor gene (PXR), что способствует частичному усилению метаболизма других ксенобиотиков.
Важным свойством антибиотиков является наличие или отсутствие взаимодействия с другими лекарственными средствами. Так, рифаксимин, в отличие от рифампицина, например, не изменяет фармакокинетику этинилэстрадиола и норгестимата, бензодиазепинов, противомалярийных средств и др.
Рифаксимин (Альфа Нормикс) может применяться и в лечебных, и в профилактических целях, основным показанием для него являются диареи путешественников. При этом терапевтическая эффективность рифаксимина сопоставима с эффективностью ципрофлоксацина. Так, по данным DuPont H. L. и соавт. (1999) при назначении рифаксимина в дозе 400 мг два раза в сутки и ципрофлоксацина в дозе 500 мг дважды в сутки в течение трех дней не выявлено достоверных различий переносимости препаратов, а время от начала лечения до последнего неоформленного стула было сравнимым в обеих группах, медиана составила 27,3 часа и 26 часов в группах рифаксимина и ципрофлоксацина соответственно (р = 0,334).
Одним из возможных направлений повышения эффективности терапии диареи путешественников является применение антиперистальтических препаратов одновременно с антибиотиком. Так, ранее было показано, что одновременное назначение азитромицина и лоперамида позволяет сократить продолжительность диареи с 34 часов до 11 часов (p = 0,0002) по сравнению с монотерапией азитромицином. Аналогичные данные были получены Dupont H. L. и соавт. (2007) при сравнении эффективности комбинированной терапии рифаксимином и лоперамидом. Среднее время от начала терапии до последнего неоформленного стула при назначении рифаксимина по 200 мг 3 раза в сутки в течение трех дней составило 32,5 ± 4,14 ч, в то время как при лечении рифаксимином одновременно с лоперамидом в дозе 4 мг первый прием и затем по 2 мг после каждого неоформленного стула — 27,3 ± 4,13 ч, а при лечении только лоперамидом по такой же схеме — 69 ± 4,11 ч (р = 0,0019). Средняя частота стула при комбинированной терапии рифаксимином–лоперамидом составила 3,99 ± 4,28 по сравнению с монотерапией рифаксимином — 6,23 ± 6,90 (р = 0,004), только лоперамидом — 6,72 ± 6,93 (р = 0,002).
Профилактическое действие рифаксимина изучалось и при шигеллезе. Так, Taylor D. N. с соавторами (2004) в экспериментальном исследовании показали, что после приема 4 доз рифаксимина, назначаемого по 200 мг 3 раза в день, при инфицировании добровольцев Shigella flexneri 2a (в дозе 1000–1500 КОЕ) клиническая картина острой дизентерии не развивалась и колонизации кишечника возбудителем не происходило. В то время как у добровольцев, получавших плацебо, в 60% случаев развивалась диарея, в т. ч. у 10% полная картина острой дизентерии, а у 50% шигеллы продолжительное время колонизировали толстую кишку (р = 0,001 по критерию Фишера).
Таким образом, рифаксимин (Альфа Нормикс) является неабсорбируемым антибиотиком местного действия с широким спектром антимикробной активности, хорошей переносимостью и безопасностью. Показана высокая клиническая и микробиологическая эффективность препарата при диареях путешественников и нетяжелом шигеллезе. Определенный интерес представляют данные об активности Альфа Нормикса в отношении простейших с точки зрения применения препарата при бактериально-протозойных инвазиях.
Таким образом, практическая деятельность инфекционистов не в полной мере соответствует официальной доктрине лечения ОКИ, излагаемой в учебниках для медицинских ВУЗов и руководствах по инфекционным болезням, приказах, методических рекомендациях и указаниях. Чем тяжелее протекает данный эпизод диарейной инфекции, тем реже в полном объеме выполняются рекомендованные диагностические исследования, тем чаще применяется комбинированная этиотропная терапия. Чаще всего для лечения ОКИ инфекций применяют три группы антимикробных препаратов — фторхинолоны, аминогликозиды и нитрофураны. Появление на отечественном рынке невсасывающегося антибиотика рифаксимина (Альфа Нормикс), эффективного при лечении прежде всего неинвазивных и нетяжелых инвазивных диарей, позволяет оптимизировать выбор этиотропных средств при ОКИ, прежде всего неустановленной природы.
С. М. Захаренко, доктор медицинских наук, профессор ВМА им. С. М. Кирова, Санкт-Петербург
По вопросам литературы обращайтесь в редакцию.
Источник
Роза Исмаиловна Ягудина, д. фарм. н., проф., зав. кафедрой организации лекарственного обеспечения и фармакоэкономики и зав. лабораторией фармакоэкономических исследований Первого МГМУ им. И. М. Сеченова.
Евгения Евгеньевна Аринина, к. м. н., ведущий научный сотрудник лаборатории фармакоэкономических исследований Первого МГМУ им. И. М. Сеченова.
С наступившим летом тема нашей статьи приобрела особую актуальность. Кишечные инфекции — это целая группа инфекционных заболеваний, поражающих в основном желудочно-кишечный тракт. Острые кишечные инфекции по своей распространенности уступают только острым респираторным заболеваниям. Пик заболеваемости обычно приходится на лето, но и в холодное время года часто встречаются кишечные инфекции, вызываемые преимущественно вирусами. Однако наиболее частая причина возникновения этих заболеваний — попадание возбудителей инфекции с загрязненными продуктами и водой в желудочно-кишечный тракт.
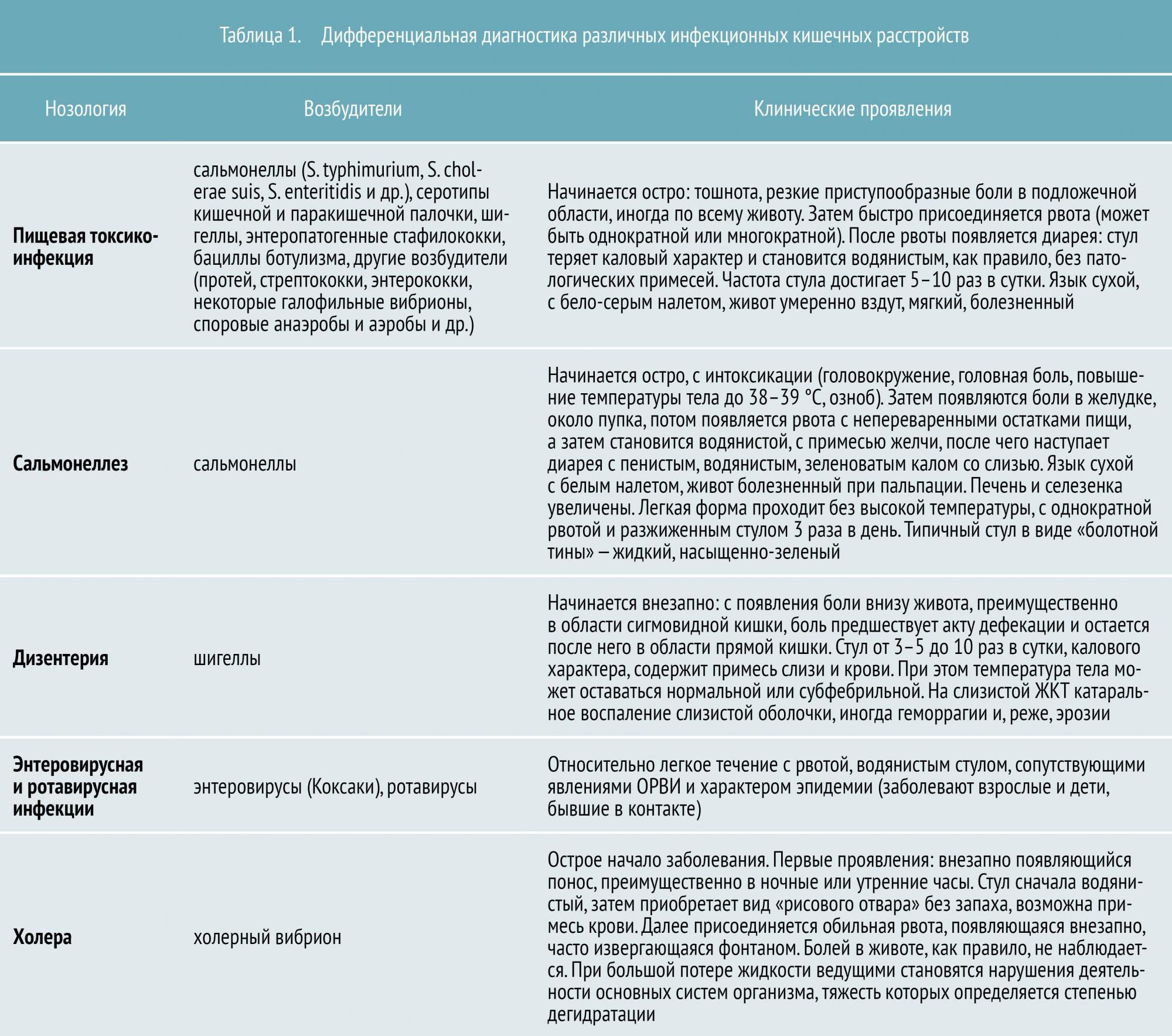
Всего в настоящее время известно около 30 инфекционных кишечных заболеваний. К наиболее распространенным относятся:
- пищевая токсикоинфекция (в основном стафилококковой этиологии)
- сальмонеллез
- дизентерия
- энтеровирусная и ротавирусная инфекция
- холера
По степени опасности их можно условно разделить на неопасные, опасные и особо опасные. Так, к неопасным относят пищевую токсикоинфекцию (ПТИ), а к особо опасным — холеру, брюшной тиф и т. д. Но это не значит, что так называемая «неопасная» ПТИ не наносит серьезного ущерба организму и не приводит к осложнениям.
Осложнения кишечных инфекций:
- бактериальные инфекции органов дыхания и среднего уха
- дисбактериоз кишечника
- кишечное кровотечение
- перфорация стенки кишки
- инвагинация кишечника
- бактериально-токсический шок
Возбудители кишечной инфекции
Помимо инфекционных агентов из естественной среды источником заражения может стать уже заболевший человек. Выделяя большое количество патогенных микроорганизмов (микробы выделяются с испражнениями, рвотными массами, иногда с мочой), больной заражает предметы, находящиеся вокруг, и, если не соблюдать меры предосторожности, может возникнуть цепная реакция в распространении инфекции.
Практически все возбудители кишечных инфекций чрезвычайно живучи. Они способы подолгу существовать в почве, воде и на различных предметах (ложках, тарелках, дверных ручках и мебели). Инфекционные микроорганизмы во внешней среде не только не погибают, но и сохраняют способность к размножению, а размножаются они наиболее активно в теплых и влажных условиях. Однако самая благоприятная среда для развития бактерий — это кисломолочные и мясные продукты.
Установлена связь отдельных форм острых кишечных инфекций с видами пищи. Так, дизентерия чаще возникает при употреблении молока и молочных продуктов, а кишечные инфекции, вызванные стафилококком, — при употреблении молочных продуктов и кондитерских изделий с кремом. Иерсиниозы обычно развиваются при употреблении сырых овощей, салатов и другой растительной пищи.
Возбудителями кишечных инфекций могут быть как бактерии (сальмонеллы, шигеллы, иерсинии, энтеропатогенные кишечные палочки, стафилококки), так и их токсины (пищевые токсикоинфекции). Вирусы (ротавирусы, энтеровирусы, астровирусы, парвовирусы) пока на втором месте по частоте встречаемости, однако в последнее время вирусные инфекции получают всё более широкое распространение. И на последнем месте — простейшие (лямблии, амебы, бластоцисты).
После попадания патогенов в организм человека, как правило, проходит бессимптомный инкубационный период, который продолжается от 6 до 48 часов — от попадания микроорганизмов в ротовую полость до момента поступления их в кишечник, где происходит их бурное размножение. После того как патогенные микроорганизмы размножились, начинается стадия клинических проявлений.
N. B.! При появлении симптомов, напоминающих острую кишечную инфекцию, необходимо срочно обратиться к инфекционисту для правильного подбора терапии и профилактики осложнений.
Наступает острый период — от 1 до 14 дней, в это время клинические проявления со стороны ЖКТ выражены максимально. Как правило, период заканчивается, когда нормализуется температура и прекращается ведущий симптом (понос или рвота).
Период реконвалесценции — не менее 2 недель, а в некоторых случаях при отсутствии лечения до нескольких лет. В этот период функция желудочно-кишечного тракта, как правило, восстанавливается не полностью — может быть неустойчивый стул.
В основном все кишечные инфекции протекают с достаточно похожими симптомами. Они всегда начинаются внезапно. В самом начале заболевания появляется резкая слабость, вялость, снижение аппетита, головная боль, повышение температуры — неспецифические симптомы, которые могут напоминать симптомы респираторных вирусных инфекций. Однако вскоре возникают тошнота, рвота, схваткообразные боли в животе, понос с примесью слизи, гноя или крови (например, при дизентерии), также могут беспокоить жажда и озноб. Среди клинических проявлений со стороны желудочно-кишечного тракта, как правило, сильнее всего выражены симптомы, связанные с пораженным органом:
- тошнота, рвота и боли в эпигастральной области (при гастрите);
- понос (при энтерите);
- рвота и понос (при гастроэнтерите);
- кровь в стуле и его нарушения (при колите);
- поражения всего кишечника (при энтероколите).
Одно из самых неблагоприятных последствий кишечной инфекции — это дегидратация организма из‑за рвоты и/или поноса и, как следствие, нарушение водно-электролитного обмена. Результатом резкой дегидратации может стать даже шок.
Однако иногда кишечные инфекции могут не иметь видимых симптомов, но сопровождаются выделением возбудителей. В плане распространения инфекции такое носительство наиболее опасно: ничего не подозревающий человек становится постоянным источником инфекции, заражая окружающих.
Врачу важно провести дифференциальную диагностику между кишечной инфекцией и соматическими заболеваниями со сходными симптомами: диареей, связанной с приемом лекарственных препаратов, острым аппендицитом, инфарктом миокарда, пневмонией, внематочной беременностью и т. д.
Диагностика и лечение кишечной инфекции
Существуют различные взаимодополняющие методы лабораторной диагностики кишечных инфекций:
- Выделение из крови возбудителя и его антигенов (токсинов)
- Бактериологическое исследование: выделение и типирование возбудителя в посевах кала, других биологических секретов и экскретов организма больного
- Вирусологическое исследование: выделение вируса из кала в посевах на культуре клеток или при электронной микроскопии
- Микроскопическое исследование: обнаружение паразитов в мазках нативного кала после обработки специальными красителями
- Выявление сывороточных антител к антигенам возбудителя и роста их титра: серологическое обследование с использованием специальных диагностикумов в реакциях (РПГА, РИГА, ИФА и т. п.); прирост титра в 4 раза.
Основные принципы терапии кишечных инфекций:
- борьба с возбудителем (антибактериальная терапия);
- борьба с обезвоживанием (как правило, для устранения недостатка жидкости пациентам назначают солевые растворы);
- устранение диареи (энтеросорбенты);
- соблюдение щадящей диеты (исключение свежих овощей и фруктов, молочных продуктов, сладкого).
Во время болезни необходимо соблюдать диету, помогающую замедлить перистальтику кишечника. Рекомендуются продукты с высоким содержанием танина (черника, черемуха, крепкий чай); вещества вязкой консистенции (слизистые супы, протертые каши, кисели); сухари; индифферентные вещества — паровые блюда из нежирного мяса и рыбы. Важный этап в лечении кишечных инфекций — исключение из рациона жареных и жирных блюд, сырых овощей и фруктов.
Главное направление лечебной тактики — нейтрализация экзотоксинов в кишечнике (энтеросорбенты) и регидратация — компенсация патологических потерь жидкости и электролитов специально разработанными глюкозо-солевыми растворами. Объем вводимых растворов зависит от степени обезвоживания и массы тела больного, а скорость введения составляет 1–1,5 л/ч. Дезинтоксикационная и регидратационная терапия в 85–95 % случаев может осуществляться перорально.
Антибиотики может назначить только инфекционист с учетом проведенных лабораторных тестов и выявленного возбудителя инфекции. Однако при выраженной диарее для ускоренной санации обоснованным является назначение антибактериальных ЛС, которые не всасываются или плохо всасываются из кишечника и обладают широким спектром действия (например, энтерофурил или ко-тримоксазол). Эффективными средствами альтернативной этиотропной терапии, в качестве препаратов от острой кишечной инфекции, являются энтеросорбенты и пробиотики. Этиотропное действие пробиотиков связано с выраженной антагонистической активностью в отношении всех возбудителей острых кишечных инфекций (ОКИ) бактериальной этиологии и опосредованным иммуномодулирующим действием на местное звено иммунитета.
Обзор лекарств для лечения кишечных инфекций
Нифуроксазид (энтерофурил)
Безрецептурное противомикробное средство широкого спектра действия, производное 5‑нитрофурана. Антимикробная активность нифуроксазида вызвана наличием в его составе NO2‑группы, которая угнетает активность дегидрогеназы и нарушает синтез белков в патогенных бактериях.
Нифуроксазид не оказывает действия на сапрофитную флору, не нарушает равновесия нормальной кишечной флоры. При острой бактериальной диарее восстанавливает эубиоз кишечника. При инфицировании энтеротропными вирусами препятствует развитию бактериальной суперинфекции. Этот препарат для лечения кишечной инфекции можно назначать беременным и кормящим женщинам, детям начиная с одного месяца. Терапия нифуроксазидом не должна превышать 7 дней, при этом запрещено употреблять алкоголь.
Кипферон
Безрецептурный препарат в форме вагинальных и ректальных суппозиториев. Обладает иммуномодулирующим, противовирусным, антихламидийным действием. Кипферон — комплексная лекарственная форма, содержащая человеческий рекомбинантный интерферон-α2 и комплексный иммуноглобулиновый препарат (КИП). Разрешен к применению у детей на первом году жизни.
Ко-тримоксазол (сульфаметоксазол + триметоприм)
Механизм действия ко-тримоксазола обусловлен двойным блокированием метаболизма микроорганизмов. Триметоприм обратимо ингибирует дигидрофолатредуктазу микроорганизмов, нарушает образование из дигидрофолиевой кислоты тетрагидрофолиевой, продукцию нуклеиновых кислот, пиримидиновых и пуриновых оснований; подавляет размножение и рост бактерий. Сульфаметоксазол, который по строению схож с парааминобензойной кислотой, захватывается бактерией и препятствует включению парааминобензойной кислоты в дигидрофолиевую кислоту. В связи с тем что ко-тримоксазол угнетает жизнедеятельность кишечной палочки, снижается образование в кишечнике никотиновой кислоты, рибофлавина, тиамина и прочих витаминов B-комплекса. Это лекарство, помогающее от кишечной инфекции, отпускается по рецепту, применяется с 2‑месячного возраста.
Бактисубтил — споры бактерий Bacillus cereus IP. Рецептурный препарат от кишечной инфекции бактисубтил сохраняет и корригирует физиологическое равновесие кишечной флоры. Споры бактерий, содержащиеся в препарате, устойчивы к действию желудочного сока. Прорастание бактерий в вегетативные формы происходит в кишечнике, затем они высвобождают энзимы, которые расщепляют углеводы, жиры, белки. В результате образуется кислая среда, предотвращающая процессы гниения. Препарат препятствует нарушению синтеза витаминов группы В и Р в кишечнике, его нельзя запивать горячим, а также сочетать с алкоголем. Детям его назначают с семилетнего возраста. Бактисубтил резистентен к действию различных антибиотиков и сульфаниламидных препаратов, поэтому может быть назначен одновременно с ними.
Декстроза + калия хлорид + натрия хлорид + натрия цитрат (регидрон)
Регидратирующее средство для перорального приема восстанавливает водно-электролитное равновесие, нарушенное при обезвоживании организма; корректирует ацидоз. Содержимое одного пакетика растворяют в литре свежепрокипяченной охлажденной питьевой воды. Приготовленный раствор нужно хранить в холодильнике и использовать в течение 24 часов. В раствор нельзя добавлять никакие другие компоненты, чтобы не нарушить действие препарата. Отпускается без рецепта.
Смектит диоктаэдрический
Безрецептурное лекарственное средство природного происхождения, обладающее протективным действием в отношении слизистой оболочки кишечника и выраженными адсорбирующими свойствами. Являясь стабилизатором слизистого барьера, образует поливалентные связи с гликопротеинами слизи и увеличивает продолжительность ее жизни, образуя физический барьер, который защищает слизистую оболочку пищеварительного тракта от отрицательного действия ионов Н+, соляной кислоты, желчных солей, микроорганизмов, их токсинов и других раздражителей. Обладает селективными сорбционными свойствами, защищает слизистую оболочку пищеварительного тракта от отрицательного воздействия. В терапевтических дозах не влияет на моторику кишечника.
Профилактика кишечных инфекций, в том числе и острых
Для профилактики кишечных инфекций важно регулярно мыть руки и проводить влажную уборку в квартире. Лучше сразу же выкидывать продукты с истекшим сроком годности, не покупать их в местах с непонятными условиями хранения — как бы ни были привлекательны, скажем, грибочки у бабушки возле метро — а фрукты и овощи есть только тщательно вымытыми.
Избежать распространения болезни поможет ранняя диагностика и изоляция больного с кишечной инфекцией. В очаге инфекции нужно обработать поверхности дезинфицирующими растворами, прокипятить посуду. Выписку пациентов проводят только после отрицательного результата контрольного обследования кала. Всем, кто перенес кишечную инфекцию, в течение месяца необходимо регулярно проходить диспансерное наблюдение в поликлинике.
Простые меры профилактики кишечных инфекций:
- пить воду и молоко только в кипяченом виде
- мыть овощи и фрукты горячей водой с мылом
- соблюдать правила и сроки хранения пищевых продуктов
- мыть руки перед едой
Источник
