Кишечная непроходимость при панкреонекрозе
Проанализированы данные, полученные в результате профилактики и лечения синдрома кишечной недостаточности (СКН) у 200 больных с панкреонекрозом; изучено влияние комплексного лечения на интраабдоминальную гипертензию и микроциркуляторные нарушения.
Рассмотрены схемы патогенетического лечения панкреонекроза, включающие как фармакотерапию, так и хирургические методы. Указаны основные факторы риска, сделан акцент на важности своевременной ликвидации СКН, как одного из ведущих патогенетических механизмов, осложняющих течение панкреонекроза.
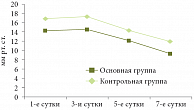
Рис. 1. Динамика средних значений внутрибрюшного давления
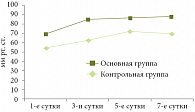
Рис. 2. Динамика средних величин перфузионного давления брюшной полости

Рис. 3. Динамика объема застойной жидкости
Таблица 1. Проявление первых перистальтических шумов, отхождения газов и первого самостоятельного стула
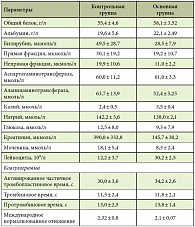
Таблица 2. Изменения биохимических показателей и эндотоксикоза при тяжелом эндотоксикозе на 7-е сутки от начала лечения
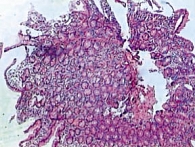
Рис. 4. Резкая дегенерация энтероцитов до начала лечения
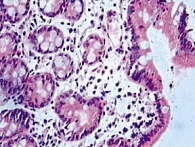
Рис. 5. Восстановление энтероцитов на 7-е сутки после начала лечения
Введение
Несмотря на успехи многокомпонентной терапии и хирургические методы лечения, летальность при панкреонекрозе составляет 20–30%, а при панкреатогенном сепсисе и полиорганной дисфункции – 70–80%. Главными факторами риска при панкреонекрозе являются: объем поражения поджелудочной железы (ПЖ), бактериальная контаминация зоны некроза, сопутствующая патология, возраст, иммунный статус и др. В настоящее время на такой фактор, как объем поражения ПЖ, оказать влияние практически невозможно, но можно воздействовать на инфицирование зоны некроза и ряд других факторов. Инфицирование зоны некроза, являющееся причиной летальности у 80% пациентов, в подавляющем большинстве случаев (80–90%) происходит из кишечника и только в 10–20% – из билиарного тракта. Установлено, что если парез кишечника, который всегда выявляется при панкреонекрозе, длится 24 часа, инфицирование зоны панкреонекроза происходит у 20% больных, 48 часов – у 40–50%, более 3 суток – у 90–100% больных [1].
Одним из ведущих патогенетических механизмов, осложняющих течение панкреонекроза, является СКН, при котором нарушаются все функции кишечника: моторная, секреторная, всасывательная, иммунная, барьерная. Синдром кишечной недостаточности играет ведущую роль в развитии эндогенной интоксикации, «кишечного» сепсиса, синдрома системного воспалительного ответа, полиорганной дисфункции и повышении летальности.
Основными проявлениями СКН являются парез кишечника (динамическая кишечная непроходимость) и увеличение внутрикишечного и внутрибрюшного давления (ВБД), которые усугубляют нарушения микроциркуляции в стенке кишечника, ведут к расстройству трофики, повышению проницаемости кишечной стенки, в результате чего происходит массивная транслокация агрессивной микробной флоры (грамотрицательные формы) и токсинов в лимфатическое русло, портальный кровоток и парапанкреатическую клетчатку. Активизируются гнилостные и бродильные процессы в кишечнике. Выделяют три стадии СКН, которые определяют характер лечебных мероприятий и уровень летальности:
- 1-я стадия (рефлекторная) – угнетение моторики и всасывания жидкости без нарушения всасывания газов;
- 2-я стадия (промежуточная) – резкое нарушение всасывания жидкости и газов, растяжение кишки, венозный стаз в ее стенке, размножение микрофлоры;
- 3-я стадия (терминальная) – тяжелые нарушения микроциркуляции и резкий отек стенки кишки с развитием панкреатогенного сепсиса.
Таким образом, можно достоверно предположить, что терапия, направленная на профилактику транслокации кишечной флоры в область ПЖ и парапанкреатической клетчатки, приводит к реальному снижению летальности, причиной которой в фазу гнойных осложнений является панкреатогенная системная воспалительная реакция.
По Чикагскому согласительному договору (1991) [2], рекомендациям которого следуют практикующие врачи в России, диагноз «сепсис» выставляется при наличии очага инфекции, диагноз «синдром системной воспалительной реакции» – при наличии двух или более органных дисфункций. Результаты посева крови при этом не имеют значения, так как даже отрицательный результат не может быть основанием для снятия диагноза «сепсис». Профилактику инфицированного панкреонекроза необходимо проводить в следующих направлениях:
- быстрая ликвидация пареза кишечника;
- эффективная стартовая антибактериальная терапия;
- улучшение микроциркуляции, в том числе с целью снижения объема и тяжести некроза;
- иммуностимуляция.
Материалы и методы
Проанализированы данные, полученные по результатам проводившихся профилактики и лечения СКН, развившегося вследствие панкреонекроза. В основной и контрольной группах (по 100 пациентов) для профилактики инфицирования панкреонекроза проводили антибактериальную терапию (фторхинолоны II–III поколения + метронидазол; при тяжести состояния выше 12 баллов по шкале оценки тяжести состояния больных при острых и хронических заболеваниях – APACHE II (acute physioligy and cronic health evaluation) назначались карбапенемы: Тиенам, Меронем)), антикоагулянтную (Гепарин, Фраксипарин, Клексан), антиоксидантную (Мексидол) и иммуностимулирующую терапию (Полиоксидоний, иммуноглобулины). В основной группе в дополнение к этой коррекции проводили терапию, направленную на профилактику и лечение СКН, которая включала следующие процедуры:
- ранний энтеральный лаваж и нутриционную поддержку;
- перидуральную блокаду;
- очистительные клизмы.
Для проведения кишечного лаважа через 2–3 часа после поступления пациента в стационар устанавливался назоэнтеральный зонд в начальный отдел тонкой кишки с помощью гастродуоденоскопа. Через зонд капельно или с помощью инфузомата вводили специальный раствор, состоящий из 100 мл вазелинового масла, 100 мл пробиотиков (применяли Хилак форте), 100 мл физиологического раствора, 100 мл 10%-ного раствора глюкозы и 100 мл сернокислой магнезии. В течение 1-х суток вводили 500 мл раствора, 2-х и 3-х суток – по 1000 мл, далее – по 1200–1500 мл раствора. В контрольной группе кишечный лаваж не проводили. Состояние всех пациентов при поступлении оценивали как тяжелое. Тяжесть состояния в контрольной и основной группах оценивали по APACHE II, а степень эндотоксикоза – по клинической классификации степени тяжести синдрома эндогенной интоксикации В.К. Гостищева [3]. Во всех случаях по этим шкалам группы наблюдаемых были сопоставимы.
В подтверждение тяжести панкреонекроза кроме клинической оценки тяжести состояния пациента применялись лабораторные методы: уровень лейкоцитоза и лейкоцитарная формула, лейкоцитарный индекс интоксикации; уровень гемоглобина, альбумина; активность амилазы крови и мочи, трансаминаз; уровень прокальцитонина, пептидов средней молекулярной массы, С-реактивного белка, кислотно-щелочного состояния, креатинина, мочевины, билирубина, функциональные резервы печени и почек, параметры иммунного статуса, оценка диуреза и мочевино-билирубинового комплекса. Дополнительно всем больным проводили инструментальные методы диагностики в динамике: ультразвуковое исследование (УЗИ), компьютерную томографию (КТ), спиральную компьютерную томографию (СКТ) с болюсным усилением, магнитно-резонансную томографию (МРТ), лапароскопию. Диагностическая лапароскопия в 62% случаев при ферментативном перитоните и сальниковом бурсите переходила в лечебную для санации и дренирования брюшной полости и сальниковой сумки. Для экстракорпоральной детоксикации (плазмаферез, гемофильтрация) у 36% больных показаниями служили: тяжесть заболевания более 15 баллов по шкале APACHE II и степень эндотоксикоза (II–III степень). Распространенность некроза проверяли по методике, предложенной М.И. Прудковым [4].
Пациенты в наблюдаемых группах, несмотря на некоторые отличия по возрасту, сопутствующей патологии, полу, в целом были сопоставимы и типированы по проводимому лечению. Билиарный панкреатит был выявлен у 17% пациентов, алкогольный – у 48%, алиментарный – у 22%, сосудистый – у 13%. До последнего времени одним из постулатов лечения острого панкреатита являлось полное голодание на протяжении 7–10 дней. При этом белково-энергетическую недостаточность в случае необходимости восполняли путем полного парентерального питания больных. Считалось, что до периода стихания воспалительных изменений в ПЖ прием пищи через рот вызывает ее дополнительную стимуляцию, что ведет к прогрессированию заболевания. В этой ситуации кишечник тяжелобольных в течение длительного времени был лишен поступления питательных ингредиентов. Однако, как известно, именно поступление пищи в просвет тонкой кишки способствует нормализации всех ее функций, что позволяет предотвратить транслокацию микроорганизмов. Было доказано отсутствие какой-либо стимуляции внешней секреции ПЖ при введении пищи дистальнее двенадцатиперстной кишки (ДПК), а именно в тощую кишку за связку Трейтца. Подобный путь введения в современных условиях легко осуществить с помощью эндоскопической установки назоэнтерального зонда.
Основной функциональной единицей ПЖ является ацинус, который даже при отеке железы вызывает внешнесекреторную недостаточность, препятствует выделению сока ПЖ в просвет ДПК. При недостаточности ферментов ПЖ развивается мальабсорбция жиров, белков и углеводов. Организм человека не имеет достаточных механизмов для длительной компенсации нарушений белково-энергетического обмена. В восстановлении пищеварительной функции и ликвидации СКН при недостаточности ферментов ПЖ при панкреонекрозе важное значение имеет также протезирование ферментной функции ПЖ.
Нами изучено влияние комплексного лечения, схема которого рассматривается в данной статье, на интраабдоминальную гипертензию (ИАГ) и микроциркуляторные нарушения в основной и контрольной группах. В течение 7 суток 2 раза в день в основной (1-й) и контрольной (2-й) группах измерялось внутрибрюшное давление по методике J. Kron и соавт. (1998), M. Cheatham и соавт. (1998) [5] через катетер в мочевом пузыре. В норме ВБД составляет 4–10 мм рт. ст., при патологии различают 4 степени ВБД: I степень – 10–15 мм рт. ст.; II степень – 16–20 мм рт. ст.; III степень – 21–25 мм рт. ст.; IV степень – более 25 мм рт. ст. Для изучения состояния системной и регионарной микроциркуляции нами использовался метод лазерной допплеровской флоуметрии (ЛДФ). Регионарная микроциркуляция измерялась интраоперационно на коже передней брюшной стенки в области пупка на 5 см латеральнее разреза до и после операции. Оценка микроциркуляции проводилась по показателям базального кровотока: М – среднеарифметическое значение показателя микроциркуляции, Q – среднее колебание перфузии, Kv – коэффициент вариации.
Результаты и обсуждение
В основной группе в 1-е сутки панкреонекроза средний уровень ВБД был 14,2 ± 1,0 мм рт. ст., на 3-и сутки – 14,5 ± 0,9 мм рт. ст., на 5-е сутки – 12,1 ± 0,7 мм рт. ст., на 7-е сутки – 9,3 ± 0,8 мм рт. ст. В контрольной группе на 1-е сутки средний уровень ВБД составил 16,9 ± 1,1 мм рт. ст., на 3-и сутки – 17,3 ± 0,8 мм рт. ст., на 5-е сутки – 14,3 ± 0,8 мм рт. ст., на 7-е сутки – 11,9 ± 0,6 мм рт. ст. Динамика изменения средних значений ВБД в обеих группах представлена на рис. 1. При наличии назоэнтеральной интубации и проведении лаважа внутрибрюшное давление снижалось, причем изменения в сторону нормализации шли быстрее.
Всем пациентам определялся уровень перфузионного давления в брюшной полости. Динамика изменений средних значений перфузионного давления брюшной полости представлена на рис. 2. Средние величины перфузионного давления брюшной полости в основной группе составили в 1-е сутки послеоперационного периода 69 ± 1,5 мм рт. ст., на 3-и сутки – 85,3 ± 2,5 мм рт. ст., на 5-е сутки – 86,8 ± 2,0 мм рт. ст., на 7-е сутки – 88,5 ± 2,5 мм рт. ст. В контрольной группе средние величины перфузионного давления брюшной полости составили в 1-е сутки 54,6 ± 1,5 мм рт. ст., на 3-и сутки – 62,9 ± 3,5 мм рт. ст., на 5-е сутки – 72,4 ± 2,0 мм рт. ст., на 7-е сутки – 69,9 ± 1,5 мм рт. ст. При всех измерениях показатели микроциркуляции оказались значительно лучше в основной группе по сравнению с показателями в контрольной группе.
Разрешение пареза и полное восстановление пассажа по кишечнику в основной группе через сутки отмечены у 36% пациентов, через 36 часов – у 24%, через 48 часов – у 28%, через трое суток – у 8%, через четверо суток – у 4%. В основной группе в течение трех суток парез разрешился у 88% больных, в более поздние сроки – у 12%. В контрольной группе парез разрешился через сутки у 16% пациентов, через 36 часов – у 11–22%, через 48 часов – у 24%, через трое суток – у 19%, через четверо суток – у 20%, через 5–7 суток – у 23% пациентов. В контрольной группе в течение первых трех суток парез разрешился у 57%, позже – у 42% пациентов.
Сброс застойного содержимого по желудочному зонду (рис. 3) в основной группе в 1-е сутки после начала лечения составил 1600 ± 400 мл, на 2–3-и сутки – 1000 ± 250 мл, на 3–5-е сутки – 300 ± 100 мл, на 5–6-е сутки – 300 ± 100 мл, на 7-е сутки – 0. В контрольной группе соответственно на 2-е сутки – 1800 ± 400 мл, на 3-и сутки – 1500 ± 300 мл, на 5-е сутки – 1200 ± 300 мл, на 6-е сутки – 750 мл, на 7-е сутки – 500 ± 100 мл и на 9-е сутки – 0.
Полное восстановление функции кишечника на 5–7-е сутки в основной группе отмечено у 48 пациентов (96%), в контрольной группе – у 42 (84%) (табл. 1). По мере восстановления перистальтики и функций кишечника снижались тяжесть состояния (в том числе по результатам биохимических показателей) и эндотоксикоз (табл. 2). Результаты анализа отчетливо продемонстрировали эффективность проводимого лечения в основной группе больных, о чем свидетельствуют также данные энтеробиопсии (рис. 4 и 5).
Инфицирование панкреонекроза в основной группе наступило у 22% пациентов, в контрольной – у 46%. При инфицированном панкреонекрозе в обеих группах в основном проведены малоинвазивные вмешательства: оментобурсостомия – 28, оментобурсостомия + люмботомия – 18, дренирование жидкостных образований под ультразвуковым (УЗ) контролем – 17, некрсеквестрэктомия – 14. Всем пацентам при оментобурсостомии и люмботомии проводили плановую санацию под контролем видеоэндоскопии. При лечении инфицированного панкреонекроза важно своевременное раскрытие, адекватная санация и дренирование всех зон некроза, что имеет основное значение в профилактике панкреатогенного сепсиса, полиорганной дисфункции и летальности. В основной группе панкреатогенный сепсис развился у 10 пациентов (10%), в контрольной – у 19 (19%); умерли в основной группе 8 пациентов (8%), в контрольной – 16 (16%).
Заключение
Таким образом, своевременная ликвидация СНК при панкреонекрозе является одним из основных компонентов патогенетического лечения этого заболевания. В структуре лечения немаловажной является коррекция метаболических нарушений, напрямую связанная с использованием растворов, содержащих электролиты, пробиотики, что позволяет в 2 раза уменьшить инфицирование, развитие сепсиса и летальность при тяжелой форме панкреонекроза.
Источник
Панкреонекроз – деструктивное заболевание поджелудочной железы, являющееся осложнением острого панкреатита и приводящее к развитию полиорганной недостаточности. К проявлениям панкреонекроза относят острую опоясывающую боль в животе, упорную рвоту, тахикардию и энцефалопатию. Лабораторная диагностика предполагает определение уровня альфа-амилазы; инструментальная – проведение обзорной рентгенографии брюшной полости, УЗИ, КТ и МРТ поджелудочной железы, РХПГ, диагностической лапароскопии. Лечение включает в себя консервативные мероприятия (угнетение протеолитических ферментов, восстановление оттока соков поджелудочной железы, дезинтоксикацию и обезболивание) и оперативное вмешательство.
Общие сведения
Панкреонекроз является наиболее тяжелым осложнением панкреатита, поражает в основном молодых трудоспособных людей, составляет 1% всех случаев острого живота. В основе патогенеза панкреонекроза лежит сбой механизмов внутренней защиты поджелудочной железы от разрушающего действия панкреатических ферментов.
В последнее время в России увеличивается количество острых панкреатитов – данная патология выходит на второе место после острого аппендицита в хирургических стационарах. Также растет и число деструктивных форм панкреатита, в частности панкреонекроза – до 20-25%. В разных клиниках летальность при деструкции поджелудочной железы достигает 30-80%. Ведущий способ снижения летальности при некрозе поджелудочной железы – своевременная диагностика, госпитализация и раннее начало патогенетического лечения.
Панкреонекроз
Причины панкреонекроза
Причинами развития, как панкреатита, так и панкреонекроза, обычно являются нарушения диеты и эпизодический прием алкоголя. Исследования в области гастроэнтерологии показали, что панкреонекрозами обычно страдают люди, не склонные к постоянному употреблению алкоголя. Тем не менее, в подавляющем большинстве случаев началу панкреонекроза предшествует эпизод употребления спиртного в больших количествах. У пациентов, страдающих хроническим алкоголизмом, практически всегда развивается хронический панкреатит, редко осложняющийся панкреонекрозом. Первые признаки заболевания могут появиться спустя часы или сутки после действия провоцирующих факторов.
Патогенез
В основе патогенеза панкреонекроза лежит нарушение местных защитных механизмов поджелудочной железы. Обильный прием пищи и алкоголя приводит к значительному усилению внешней секреции, перерастяжению протоков поджелудочной железы, нарушению оттока панкреатических соков. Повышение внутрипротокового давления провоцирует отек паренхимы, разрушение ацинусов поджелудочной железы, преждевременную активацию протеолитических ферментов, которые и приводят к массивному некрозу ткани железы (самоперевариванию).
Активация липазы вызывает некроз жировых клеток, эластазы – разрушение сосудистой стенки. Активированные ферменты и продукты распада тканей, благодаря воздействию эластазы, попадают в кровоток, оказывая токсическое действие на все органы и ткани. В первую очередь страдают печень, почки, сердце, головной мозг.
Классификация
В зависимости от того, какие повреждающие механизмы лидируют в патогенезе, выделяют жировую, геморрагическую и смешанную формы панкреонекроза.
- Жировая форма. Если преобладает повышение активности липазы, происходит разрушение жировой ткани поджелудочной железы. Липаза попадает за пределы панкреатической капсулы, вызывая появление очагов некроза в большом и малом сальнике, листках брюшины, брыжейке, внутренних органах. Жировая форма панкреонекроза обычно оканчивается развитием тяжелейшего химического асептического перитонита, полиорганной недостаточности.
- Геморрагическая форма. В случае же преобладания микроциркуляторных нарушений развивается спазм сосудов поджелудочной железы, приводящий к быстрому нарастанию отека паренхимы. В течение нескольких часов или дней токсемия постепенно приводит к парезу сосудистой стенки, расширению сосудов и замедлению кровотока в тканях железы. Все это способствует повышенному тромбообразованию, а в дальнейшем – развитию ишемического некроза. Активация эластазы вызывает разрушение сосудистой стенки сначала в толще поджелудочной железы, затем и в других органах. В конечном итоге это ведет к геморрагическому пропитыванию панкреас, кровоизлияниям во внутренние органы и забрюшинную клетчатку. Признаком геморрагического панкреонекроза является выпот в брюшную полость с примесью крови.
- Смешанная форма. Если активность эластазы и липазы находятся примерно на одном уровне, развивается смешанная форма панкреонекроза. В этом случае явления жирового некроза и геморрагической имбибиции выражены одинаковы. При панкреонекрозе также значительно повышается уровень альфа-амилазы, однако в патогенезе этот факт не играет никакой роли. Измерение уровня амилазы имеет только клиническое значение.
Симптомы панкреонекроза
Развитие клиники панкреонекроза происходит в три этапа. Этому состоянию может предшествовать гнойный панкреатит, острый алкогольный панкреатит, билиарный панкреатит, геморрагический панкреатит. На первом этапе активное размножение бактерий в поджелудочной железе вызывает выраженную токсинемию и усиление панкреатической ферментативной активности. Пациента беспокоят лихорадка, рвота, неустойчивость стула. На втором этапе заболевания происходит гнойное и ферментативное расплавление тканей железы с формированием одной или нескольких каверн. На последней стадии воспалительный процесс распространяется на окружающие ткани, приводя к полиорганной недостаточности и смерти больного.
Заболевание имеет острое начало, обычно пациенты четко связывают появление первых симптомов с погрешностями в диете и приемом алкоголя. Около 70% больных поступают в стационар в состоянии сильного алкогольного опьянения, что говорит об очень быстром развитии патологических изменений в поджелудочной железе.
Первым симптомом обычно выступает острая опоясывающая боль, иррадиирующая в левую половину живота и поясницы, левое плечо. Безболевых форм панкреонекроза не бывает. Между выраженностью болевого синдрома и тяжестью некроза поджелудочной железы существует прямая зависимость. Распространение деструктивных изменений на нервные окончания приводит к постепенному уменьшению болевого синдрома, в сочетании с сохраняющейся интоксикацией это является плохим прогностическим признаком.
Через некоторое время после появления боли развивается неукротимая рвота, не связанная с приемом пищи и не приносящая облегчения. В рвотных массах содержится желчь, сгустки крови. Из-за рвоты развивается дегидратация, проявляющаяся сухостью кожи и слизистых, язык обложен, постепенно снижается темп диуреза. Развивается метеоризм кишечника, перистальтика ослаблена, отмечается задержка газов и стула. Интоксикация и дегидратация сопровождаются лихорадкой.
Токсемия, колебания уровня глюкозы в крови, гиперферментемия приводят к поражению головного мозга и развитию энцефалопатии, которая выражается спутанностью сознания, возбуждением, дезориентацией, вплоть до развития комы (примерно у трети пациентов).
Прогрессирование воспалительного процесса приводит к значительному увеличению поджелудочной железы в размерах, формированию инфильтрата в брюшной полости. Уже к пятым суткам от начала заболевания инфильтрат можно не только пропальпировать, но и увидеть невооруженным глазом. В проекции поджелудочной железы появляется гиперестезия кожи.
Осложнения
Указанные патологические сдвиги в организме приводят к формированию полиорганной недостаточности на фоне тяжелого токсического гепатита, нефрита, кардита, дыхательных нарушений. Панкреонекроз может осложняться шоком, перитонитом, абсцессом брюшной полости, желудочно-кишечными кровотечениями.
Из местных осложнений часто встречаются абсцесс, киста или ложная киста поджелудочной железы, ферментная недостаточность, фиброз поджелудочной железы, флегмона забрюшинной клетчатки, язвы ЖКТ, тромбоз воротной и мезентериальных вен.
Диагностика
Осмотр пациента должен осуществляться совместно гастроэнтерологом, хирургом, реаниматологом. Наличие панкреонекроза предполагает крайнюю тяжесть состояния пациента, поэтому во всех случаях рекомендуется госпитализация в отделение интенсивной терапии. В отделении производится постоянное определение ферментов поджелудочной железы в крови и моче. Плохим прогностическим признаком является прогрессирующий рост уровня амилазы либо резкий скачок данного показателя.
При физикальном осмотре отмечается вздутие живота, на боковых поверхностях передней брюшной стенки и пояснице появляются синюшные пятна (проявление внутренних гематом, кровоизлияний в мягкие ткани). Кожные покровы землисто-бледные или желтушные, мраморные, холодные. Тахикардия, артериальная гипотония, учащенное поверхностное дыхание являются признаком тяжелой интоксикации. Диагноз подтверждается с помощью:
- Рентгенодиагностики. Обзорная рентгенография органов брюшной полости позволяет выявить косвенные признаки воспалительного процесса. Введение контрастного вещества может дать возможность визуализировать фистулы поджелудочной железы. Исследовать состояние выводящих протоков поджелудочной железы, выявить причину застоя панкреатического сока позволяет ретроградная холангиопанкреатография.
- УЗИ-диагностики. Ультрасонография поджелудочной железы и желчных путей указывает на наличие камней в желчевыводящих протоках, увеличение и изменение структуры железы, анэхогенные очаги некроза в полости живота.
- Томографической диагностики. Более детально визуализировать патологические изменения можно с помощью МРТ поджелудочной железы, МРПХГ, компьютерной томографии.
- Диагностической операции. В сложных случаях проводится диагностическая лапароскопия – наиболее точный способ визуализации и постановки диагноза, оценки состояния поджелудочной железы и окружающих тканей и органов.
Дифференциальный диагноз проводят с кишечной непроходимостью, острыми воспалительными заболеваниями аппендикса, желчного пузыря, желчной коликой, перфорацией полого органа, тромбозом мезентериальных сосудов, инфарктом миокарда, разрывом аневризмы брюшной аорты.

КТ ОБП. Панкреонекроз. Диффузный отек и нарушение структуры поджелудочной железы, отсутствие накопления контраста в ее паренхиме.
Лечение панкреонекроза
Консервативная терапия
Лечение панкреонекроза начинают с обеспечения полного покоя воспаленной поджелудочной железе. Исключаются физические нагрузки, энтеральное питание, может назначаться промывание желудка прохладными растворами. Основными направлениями лечения являются обезболивание, обезвреживание протеолитических ферментов, дезинтоксикационная терапия.
- Аналгезия. Адекватное обезболивание включает в себя введение анальгетиков (при необходимости – наркотических), спазмолитиков, рассечение капсулы поджелудочной железы, новокаиновые блокады. Уменьшение отека железы под влиянием диуретиков приводит к угасанию болевого синдрома (так как ведет к ослаблению натяжения панкреатической капсулы).
- Инфузионная терапия. Дезинтоксикация проводится большим количеством инфузионных растворов под контролем диуреза. В инфузионный раствор добавляют апротинин. Обязательно назначаются антигистаминные препараты.
- Антибиотикотерапия. С целью профилактики гнойных осложнений проводится антибактериальная терапия антибиотиками широкого спектра действия. Симптоматическое лечение включает в себя противошоковые мероприятия, восстановление функции других органов и систем.
Хирургическое лечение
Практически во всех случаях развития панкреонекроза требуется проведение хирургического лечения для восстановления оттока панкреатических соков, удаления некротических масс (некрэктомия поджелудочной железы). В первые пять суток от начала патологического процесса проводить оперативное вмешательство не рекомендуется, так как в эти сроки еще невозможно оценить уровень некроза, зато повышается риск вторичного инфицирования и послеоперационных осложнений.
На этапе гнойного воспаления в брюшной полости могут использоваться разнообразные методики (пункционные, лапароскопические, лапаротомные) восстановления оттока из протоков поджелудочной железы; устранения некротических масс, воспалительного и геморрагического экссудата; остановки внутрибрюшного кровотечения. Для улучшения состояния внутренних органов может потребоваться дренирование брюшной полости.
Прогноз и профилактика
Составление прогноза для пациентов с панкреонекрозом является очень сложной задачей, так как зависит от многих обстоятельств. Значительно ухудшается прогноз при наличии одного или нескольких из следующих факторов: возраст более пятидесяти пяти лет, лейкоцитоз более 16х109/л, гипергликемия, гипокальциемия, метаболический ацидоз, артериальная гипотензия, повышение уровня мочевины, ЛДГ и АСТ, значительные потери жидкости из кровеносного русла в ткани. Наличие семи из указанных критериев обеспечивает 100% летальность пациента. Профилактика панкреонекроза заключается в своевременном обращении за медицинской помощью, раннем начале лечения, в том числе и хирургического.
Источник
