Кишечная палочка и среда гисса
ПИТАТЕЛЬНЫЕ СРЕДЫ
(для просмотра изображений в полном размере, щелкните по ним правой кнопкой мыши и выберите пункт “ОТКРЫТЬ ИЗОБРАЖЕНИЕ В НОВОЙ ВКЛАДКЕ”)
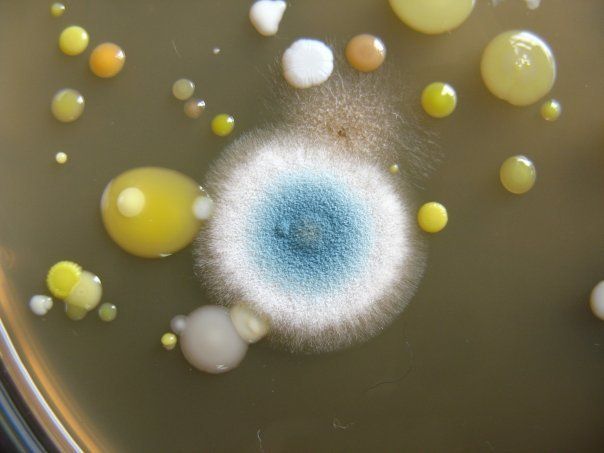
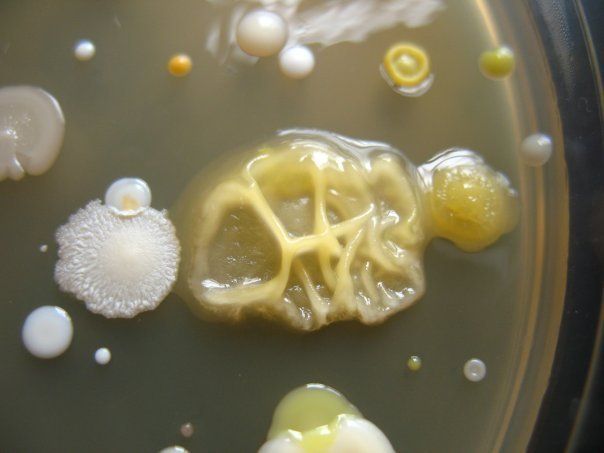 ПИТАТЕЛЬНЫЙ АГАР используют для выращивания бактерий, содержит гидролизат кильки, экстракт дрожжей, агар, хлорид натрия и дистиллированную воду. Растворяют ингредиенты, кипятят, фильтруют, стерилизуют (120 гр. С 20 минут). Затем разливают в стерильные пробирки или чашки Петри. На чашке с агаром видны разнообразные колонии микробов, выросшие в при посеве воздуха.
ПИТАТЕЛЬНЫЙ АГАР используют для выращивания бактерий, содержит гидролизат кильки, экстракт дрожжей, агар, хлорид натрия и дистиллированную воду. Растворяют ингредиенты, кипятят, фильтруют, стерилизуют (120 гр. С 20 минут). Затем разливают в стерильные пробирки или чашки Петри. На чашке с агаром видны разнообразные колонии микробов, выросшие в при посеве воздуха.
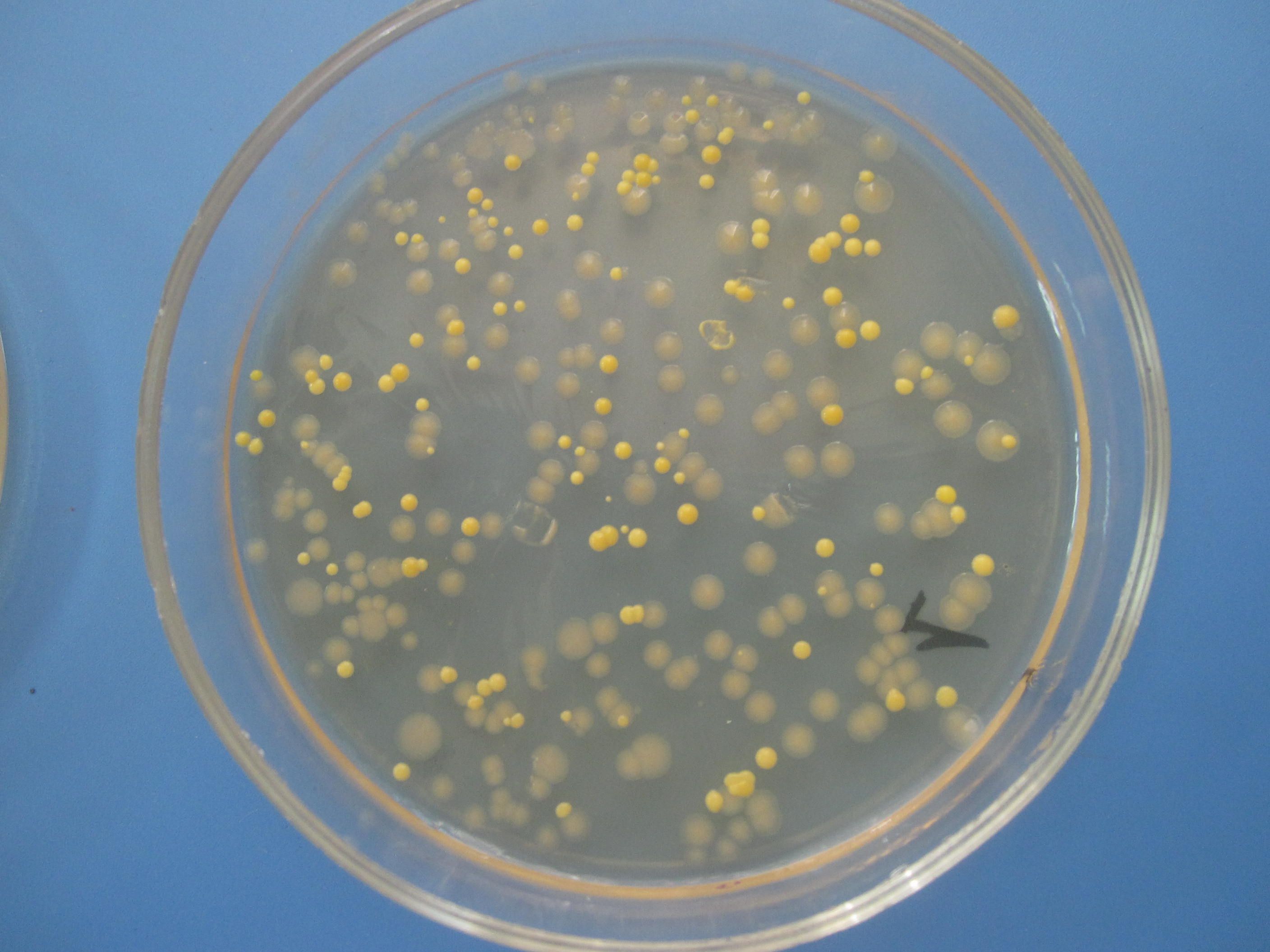
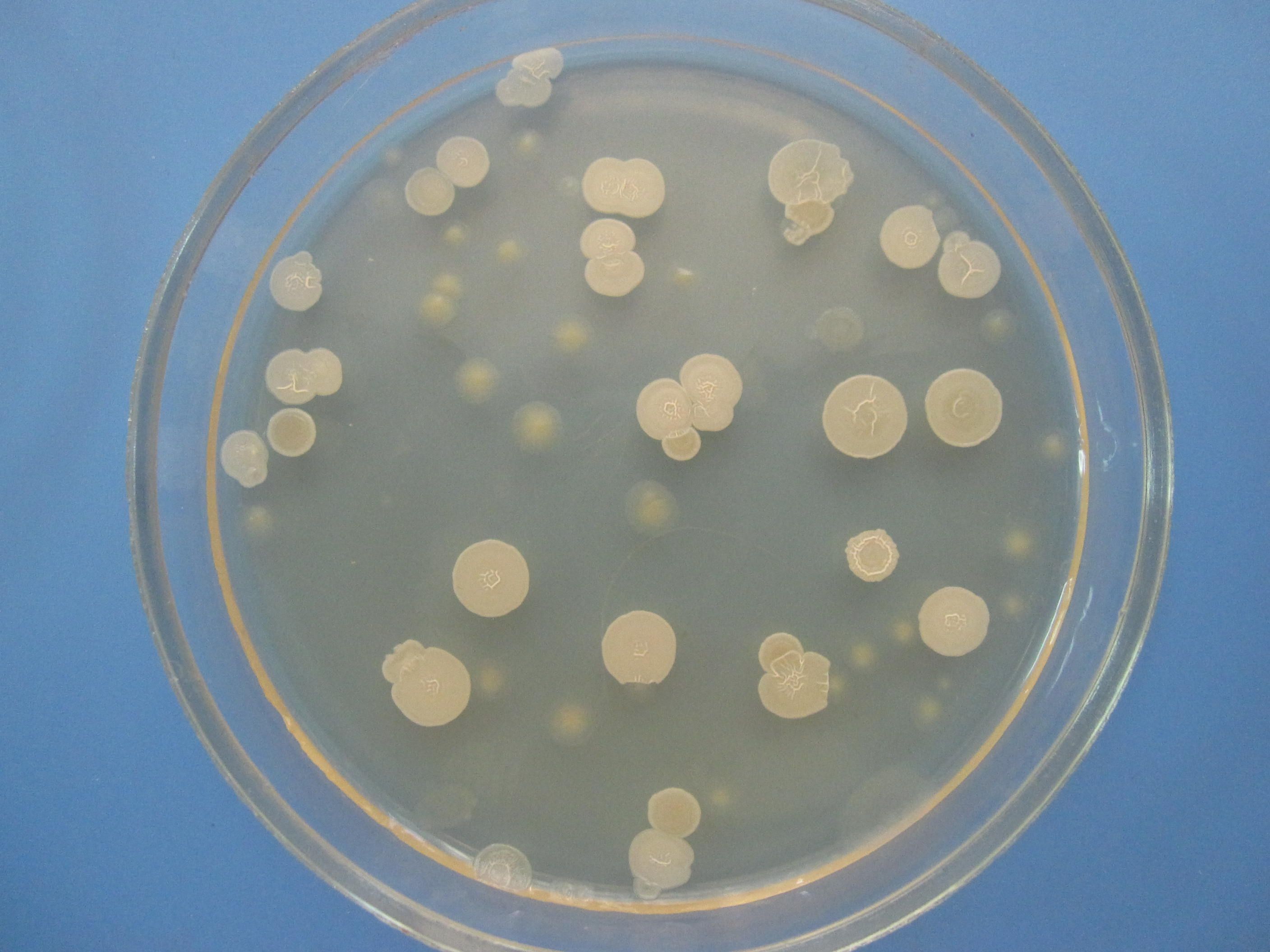 СМЕСЬ БАКТЕРИЙ
СМЕСЬ БАКТЕРИЙ
На чашке с МПА видны различные колонии бактерий, отличающиеся по цвету, форме, размерам, прозрачности…. Культуральные свойства Escherichia coli: круглые с ровными краями, гладкие, влажные, слизистые, полупрозрачные колонии.
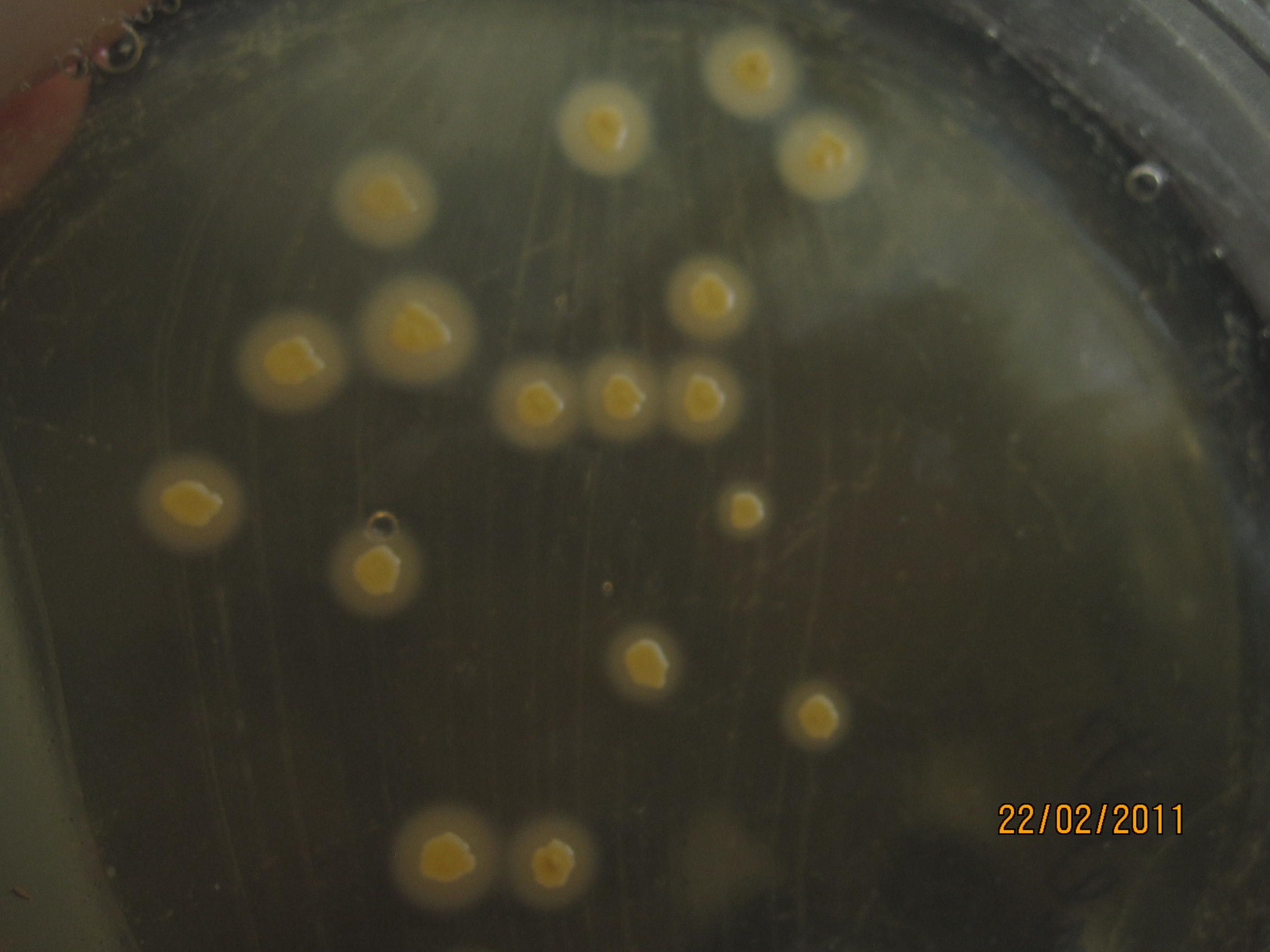
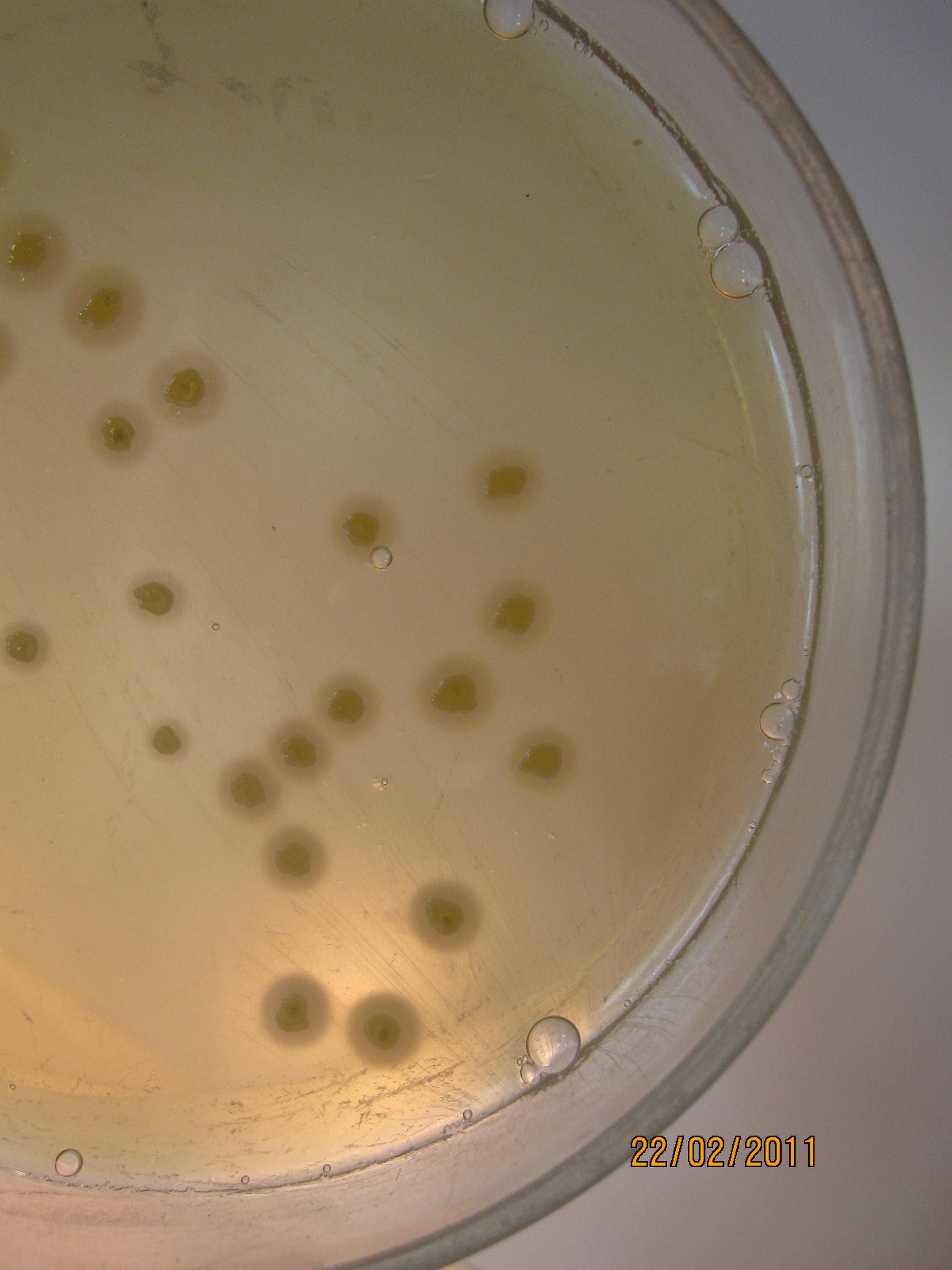 ЖЕЛТОЧНО-СОЛЕВОЙ АГАР ЧИСТОВИЧА – селективная среда, предназначенная для культивирования стафилококков. Содержит питательный агар, желток куриного яйца, повышенные концентрации хлорида натрия (8-10%), которые не препятствуют размножению стафилококков и обеспечивают элективность среды для данных микробов. Среда позволяет дифференцировать лецитиназопозитивные стафилококки, вокруг колоний которых образуются зоны помутнения с перламутровым оттенком.
ЖЕЛТОЧНО-СОЛЕВОЙ АГАР ЧИСТОВИЧА – селективная среда, предназначенная для культивирования стафилококков. Содержит питательный агар, желток куриного яйца, повышенные концентрации хлорида натрия (8-10%), которые не препятствуют размножению стафилококков и обеспечивают элективность среды для данных микробов. Среда позволяет дифференцировать лецитиназопозитивные стафилококки, вокруг колоний которых образуются зоны помутнения с перламутровым оттенком.
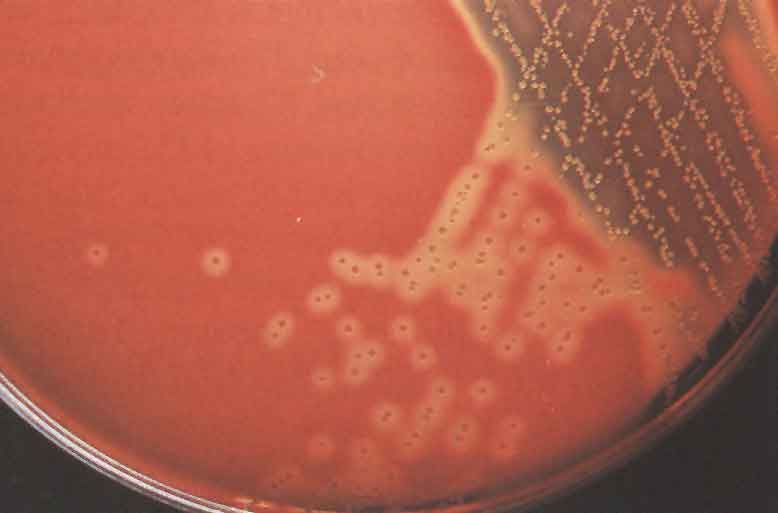
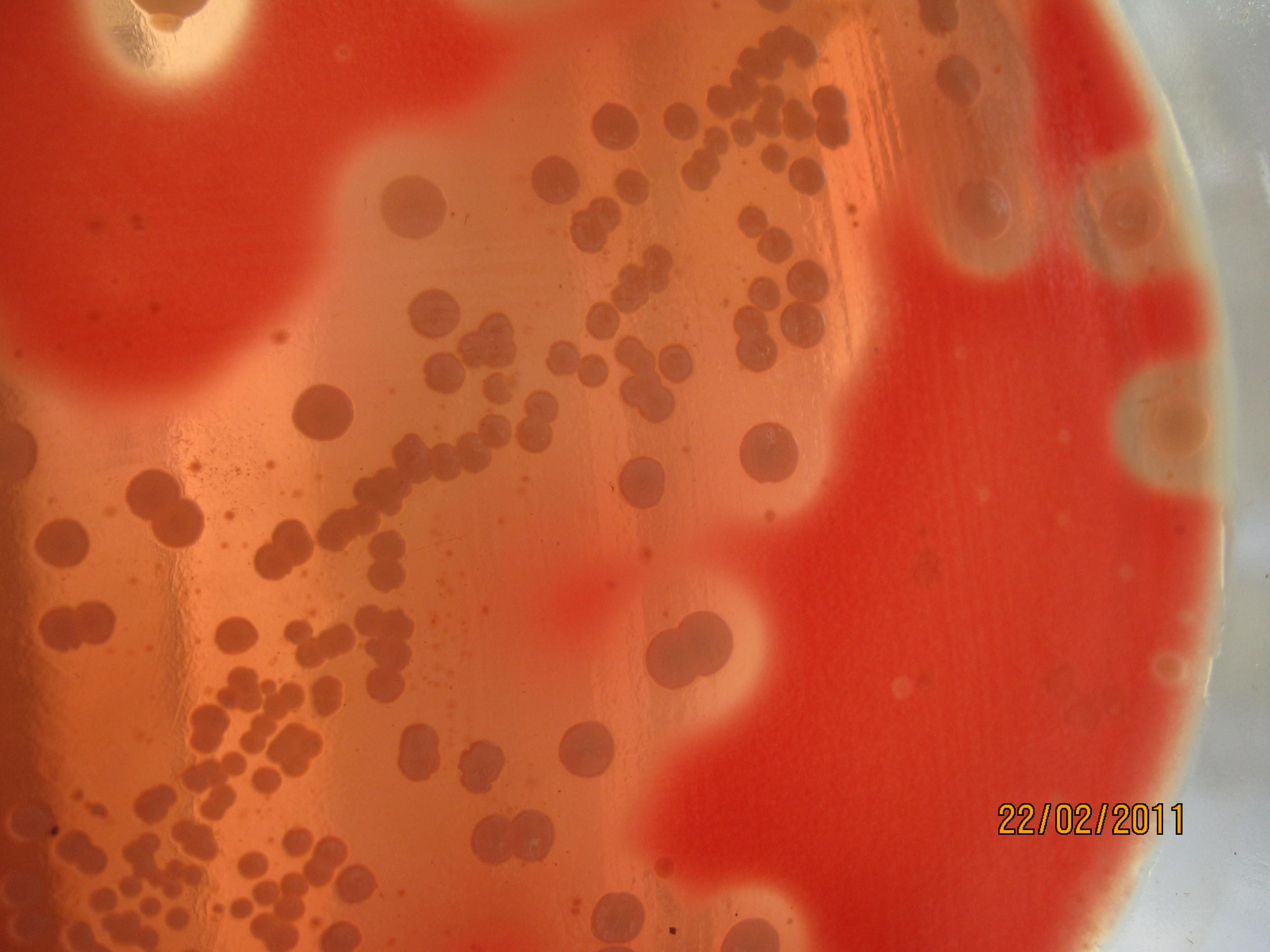 КРОВЯНОЙ АГАР питательная среда для выявления гемолитических свойств бактерий. К расплавленному остуженному (до 45-50 гр С) питательному агару асептически добавляют 5-10% дефибринированной крови, хорошо перемешивают и сразу же разливают в чашки Петри. Вокруг выросших колоний отчетливо видны прозрачные зоны гемолиза.
КРОВЯНОЙ АГАР питательная среда для выявления гемолитических свойств бактерий. К расплавленному остуженному (до 45-50 гр С) питательному агару асептически добавляют 5-10% дефибринированной крови, хорошо перемешивают и сразу же разливают в чашки Петри. Вокруг выросших колоний отчетливо видны прозрачные зоны гемолиза.
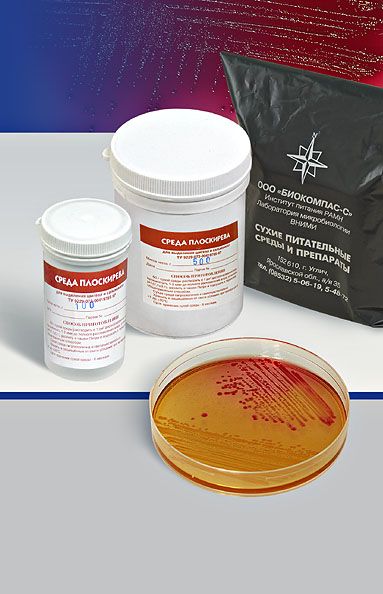
 СРЕДА ПЛОСКИРЕВА – дифференциально-диагностическая и селективная, способствует лучшему росту некоторых бактерий (возбудители брюшного тифа, паратифов, дизентерий) и подавляет рост других (кишечная палочка и пр.). Содержит питательный агар с лактозой, бриллиантовым зеленым, солями желчных кислот, минеральными солями и индикатором (нейтральный красный). Лактозонегативные колонии вырастают бесцветными, лактозопозитивные – красными. На некоторых модификациях среды Плоскирева выявляется еще и способность сальмонелл выделять сероводород: выросшие колонии чернеют.
СРЕДА ПЛОСКИРЕВА – дифференциально-диагностическая и селективная, способствует лучшему росту некоторых бактерий (возбудители брюшного тифа, паратифов, дизентерий) и подавляет рост других (кишечная палочка и пр.). Содержит питательный агар с лактозой, бриллиантовым зеленым, солями желчных кислот, минеральными солями и индикатором (нейтральный красный). Лактозонегативные колонии вырастают бесцветными, лактозопозитивные – красными. На некоторых модификациях среды Плоскирева выявляется еще и способность сальмонелл выделять сероводород: выросшие колонии чернеют.
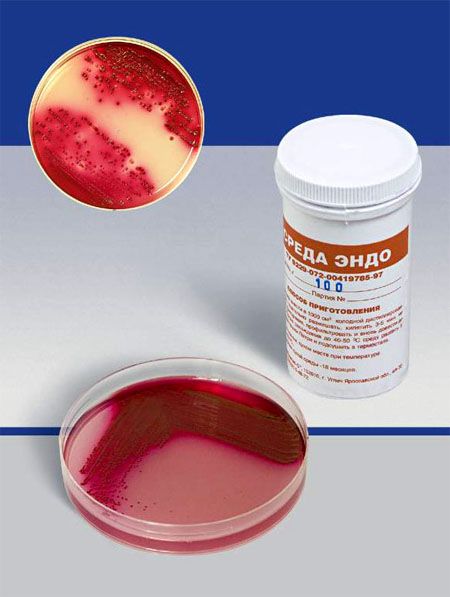
 СРЕДА ЭНДО предназначена для выделения энтеробактерий, обнаружения эшерихий. Состоит из питательного агара, 1% лактозы и индикатора – основного фуксина, обесцвеченного сульфитом натрия. Свежеприготовленная среда бесцветна или имеет бледно-розовую окраску. При росте лактозоположительных бактерий их колонии окрашиваются в темно-красный цвет с металлическим блеском; лактозоотрицательные кишечные палочки образуют бесцветные колонии.
СРЕДА ЭНДО предназначена для выделения энтеробактерий, обнаружения эшерихий. Состоит из питательного агара, 1% лактозы и индикатора – основного фуксина, обесцвеченного сульфитом натрия. Свежеприготовленная среда бесцветна или имеет бледно-розовую окраску. При росте лактозоположительных бактерий их колонии окрашиваются в темно-красный цвет с металлическим блеском; лактозоотрицательные кишечные палочки образуют бесцветные колонии.
 СРЕДА ОЛЬКЕНИЦКОГО (ТРЕХСАХРНЫЙ АГАР) предназначена для дифференциации энтеробактерий по способности сбраживать углеводы в присутствии индикатора.
СРЕДА ОЛЬКЕНИЦКОГО (ТРЕХСАХРНЫЙ АГАР) предназначена для дифференциации энтеробактерий по способности сбраживать углеводы в присутствии индикатора.
Рост на трехсахарном железосодержащем агаре:
1. Контроль (незасеянная среда)
2. Salmonella серовара Typhimurium
3. Escherichia coli
4. Shigella flexneri
5. Salmonella серовара Typhi
Пептический перевар животной ткани, гидролизат казеина, дрожжевой и мясной экстракты являются источником азотистых веществ, серы, микроэлементов, витаминов группы В и др. Лактоза, сахароза и глюкоза – ферментируемые субстраты. Тиосульфат натрия в сочетании с ионами железа являются индикатором на сероводород, феноловый красный – индикатор рН.
Микроорганизмы, ферментирующие глюкозу, способствуют образованию многих кислот, изменяющих цвет среды с красного на желтый. Большее количество кислот освобождается в столбике (при ферментации), по сравнению со скошенной частью (окисление). Бактерии образуют также щелочные продукты (в ходе окислительного декарбоксилирования пептона). Принципиальное значение имеет соотношение глюкоза/лактоза(сахароза) = 1:10. Индикатор феноловый красный становится желтым при значениях рН менее 6,8. При исходном значении рН=7,4 требуется относительно небольшое количество кислот для развития желтого окрашивания среды. Щелочные продукты могут нейтрализовать небольшое количество кислоты, образуемое в скошенной части при ферментации глюкозы. Таким образом, щелочной (красный) скос и кислый (желтый) столбик указывают, что микроорганизм ферментирует глюкозу, но не ферментирует лактозу и/или сахарозу. Бактерии, ферментирующие помимо глюкозы лактозу и/или сахарозу, образуют большое количество кислот, которое не может быть нейтрализовано аминами, поэтому скос и столбик будут кислыми (желтыми). Если в ходе ферментации образуется газ, его можно определить по пузырькам и характерным разрывам среды. Некоторые виды бактерий восстанавливают тиосульфат до сероводорода, который, взаимодействуя с ионами железа, образует нерастворимый черный преципитат сульфида железа. Восстановление тиосульфата происходит только в кислой среде и почернение обычно бывает в зоне столбика.
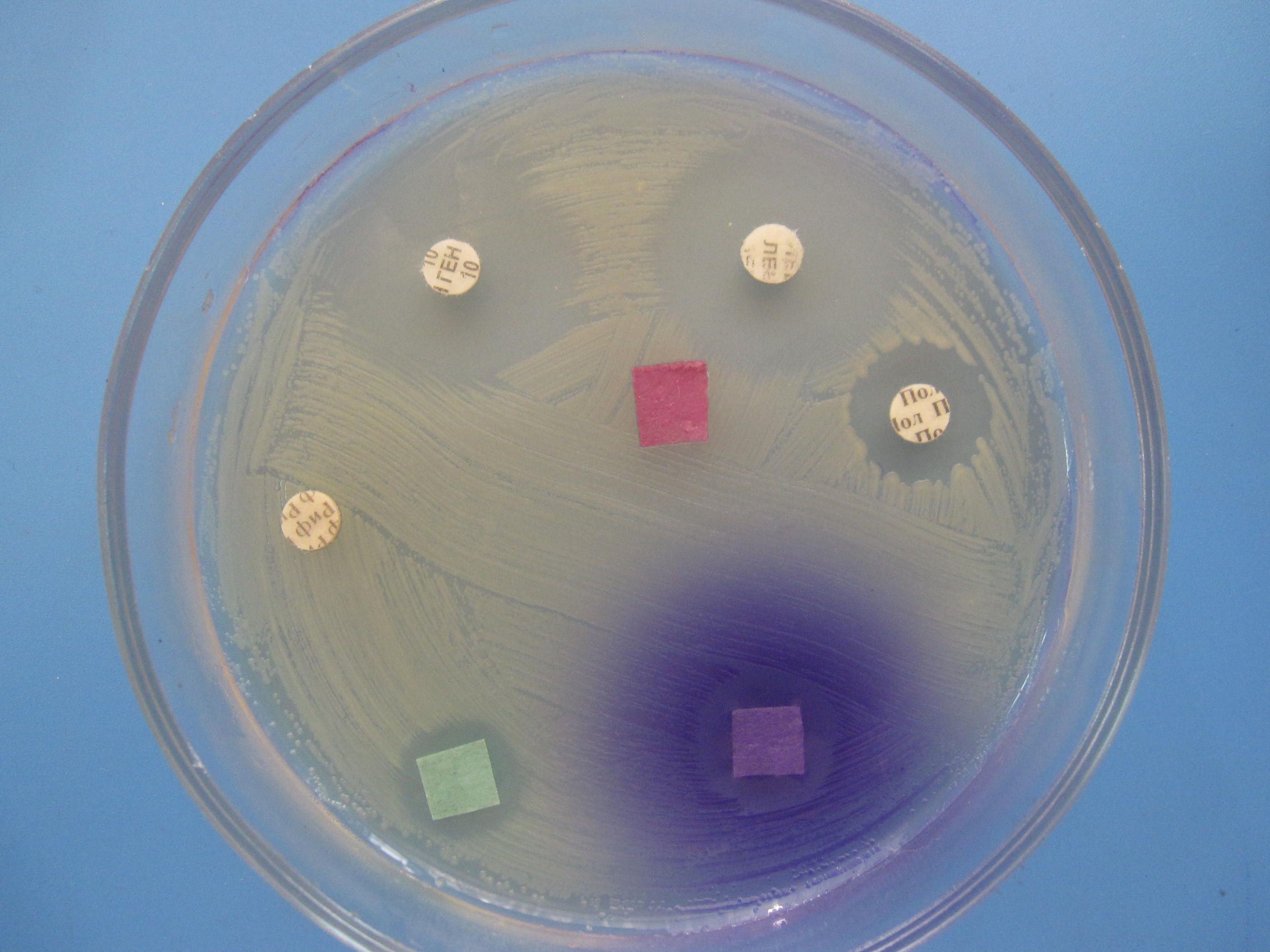 ОПРЕДЕЛЕНИЕ ЧУВСТВИТЕЛЬНОСТИ БАКТЕРИЙ К АНТИБИОТИКАМ МЕТОД ДИСКОВ
ОПРЕДЕЛЕНИЕ ЧУВСТВИТЕЛЬНОСТИ БАКТЕРИЙ К АНТИБИОТИКАМ МЕТОД ДИСКОВ
Бактериальную культуру засевают газоном на питательный агар, после чего на его поверхность пинцетом помещают на равномерном расстоянии друг от друга бумажные диски, содержащие определенные дозы разных антибиотиков. Посевы инкубируют при 37 0 С в течение суток. По диаметру зон задержки роста культуры судят о ее чувствительности к соответствующим антибиотикам. При зоне задержки роста до 15 мм культура расценивается как нечувствительная или низко чувствительная, 15 – 24 мм – средняя чувствительность, 25 мм и более – высокочувствительная.

 СРЕДА ВИЛЬСОНА-БЛЕРА
СРЕДА ВИЛЬСОНА-БЛЕРА
(ЖЕЛЕЗО-СУЛЬФИТНЫЙ АГАР) используется для выделения анаэробных бактерий. Готовится из питательного агара, к которому добавляют 1% глюкозы, хлорид железа и сульфит натрия. Анаэробные клостридии (Clostridium perfringens) образуют на среде колонии черного цвета за счет образования соединений железа с серой.
 ВИСМУТ-СУЛЬФИТНЫЙ АГАР селективная среда для выделения сальмонелл. Готовая среда непрозрачна, зеленоватого цвета. Содержит глюкозу, неорганические соли, бриллиантовый зеленый, питательный агар. Бриллиантовый зеленый и висмут подавляют рост грамположительной флоры и многих энтеробактерий, в том числе шигелл, эшерихий. Сальмонеллы при росте на среде выделяют сероводород, который взаимодействует с солями висмута. В результате образуются колонии черного цвета с металлическим оттенком на зеленоватом фоне среды.
ВИСМУТ-СУЛЬФИТНЫЙ АГАР селективная среда для выделения сальмонелл. Готовая среда непрозрачна, зеленоватого цвета. Содержит глюкозу, неорганические соли, бриллиантовый зеленый, питательный агар. Бриллиантовый зеленый и висмут подавляют рост грамположительной флоры и многих энтеробактерий, в том числе шигелл, эшерихий. Сальмонеллы при росте на среде выделяют сероводород, который взаимодействует с солями висмута. В результате образуются колонии черного цвета с металлическим оттенком на зеленоватом фоне среды.

 СРЕДЫ ГИССА дифференциально-диагностические питательные среды для выявления ферментативной активности бактерий (кишечной группы). Содержат 1% пептонную воду, 0,5% раствор определенного углевода (глюкоза, лактоза, мальтоза, манит, сахароза и др.) и индикатор Андреде (кислый фуксин в растворе NaOH). Среда при рН 7,2-7,4 – бесцветна, при ферментации углеводов приобретает красный цвет . В пробирки со средой помещают поплавок (небольшая трубочка, один конец которой запаян) для улавливания газообразных продуктов, образующихся при расщеплении углеводов.
СРЕДЫ ГИССА дифференциально-диагностические питательные среды для выявления ферментативной активности бактерий (кишечной группы). Содержат 1% пептонную воду, 0,5% раствор определенного углевода (глюкоза, лактоза, мальтоза, манит, сахароза и др.) и индикатор Андреде (кислый фуксин в растворе NaOH). Среда при рН 7,2-7,4 – бесцветна, при ферментации углеводов приобретает красный цвет . В пробирки со средой помещают поплавок (небольшая трубочка, один конец которой запаян) для улавливания газообразных продуктов, образующихся при расщеплении углеводов.
 СРЕДА КИТТА-ТАРОЦЦИ обеспечивает рост многих спорообразующих и строгих аспорогенных анаэробов. Ее используют для культивирования и хранения клостридий. Состоит из питательного бульона, 2% глюкозы и кусочков печени или мясного фарша для адсорбции кислорода. Перед посевом среду прогревают на кипящей водяной бане в течение 10-15 минут для удаления воздуха. После посева среду заливают небольшим слоем вазелинового масла. Выросшие анаэробы вызывают помутнение питательной среды.
СРЕДА КИТТА-ТАРОЦЦИ обеспечивает рост многих спорообразующих и строгих аспорогенных анаэробов. Ее используют для культивирования и хранения клостридий. Состоит из питательного бульона, 2% глюкозы и кусочков печени или мясного фарша для адсорбции кислорода. Перед посевом среду прогревают на кипящей водяной бане в течение 10-15 минут для удаления воздуха. После посева среду заливают небольшим слоем вазелинового масла. Выросшие анаэробы вызывают помутнение питательной среды.
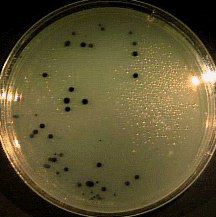
 ФАГОИДЕНТИФИКАЦИЯ БАКТЕРИЙ ПО МЕТОДУ ОТТО (МЕТОД СТЕКАЮЩЕЙ КАПЛИ)
ФАГОИДЕНТИФИКАЦИЯ БАКТЕРИЙ ПО МЕТОДУ ОТТО (МЕТОД СТЕКАЮЩЕЙ КАПЛИ)
На чашку с МПА шпателем выполняется посев суточной бульонной культуры бактерий. Затем наносят каплю известного бактериофага и, наклонив чашку, дают капле несколько растечься по поверхности питательной среды. Через сутки наблюдают полную задержку роста в месте внесения диагностического фага.
 ФАГОТИПИРОВАНИЕ БАКТЕРИЙ ПО МЕТОДУ ФИШЕРА
ФАГОТИПИРОВАНИЕ БАКТЕРИЙ ПО МЕТОДУ ФИШЕРА
Испытуемую суточную бульонную культуру засевают на МПА, затем условно делят чашку на квадраты. В каждый квадрат наносят по одной капле различных фагов. После суточной инкубации в термостате отмечают квадраты, в которых отмечается лизис бактерий. Фаготип бактериальной культуры определяется типом лизирующего ее фага.
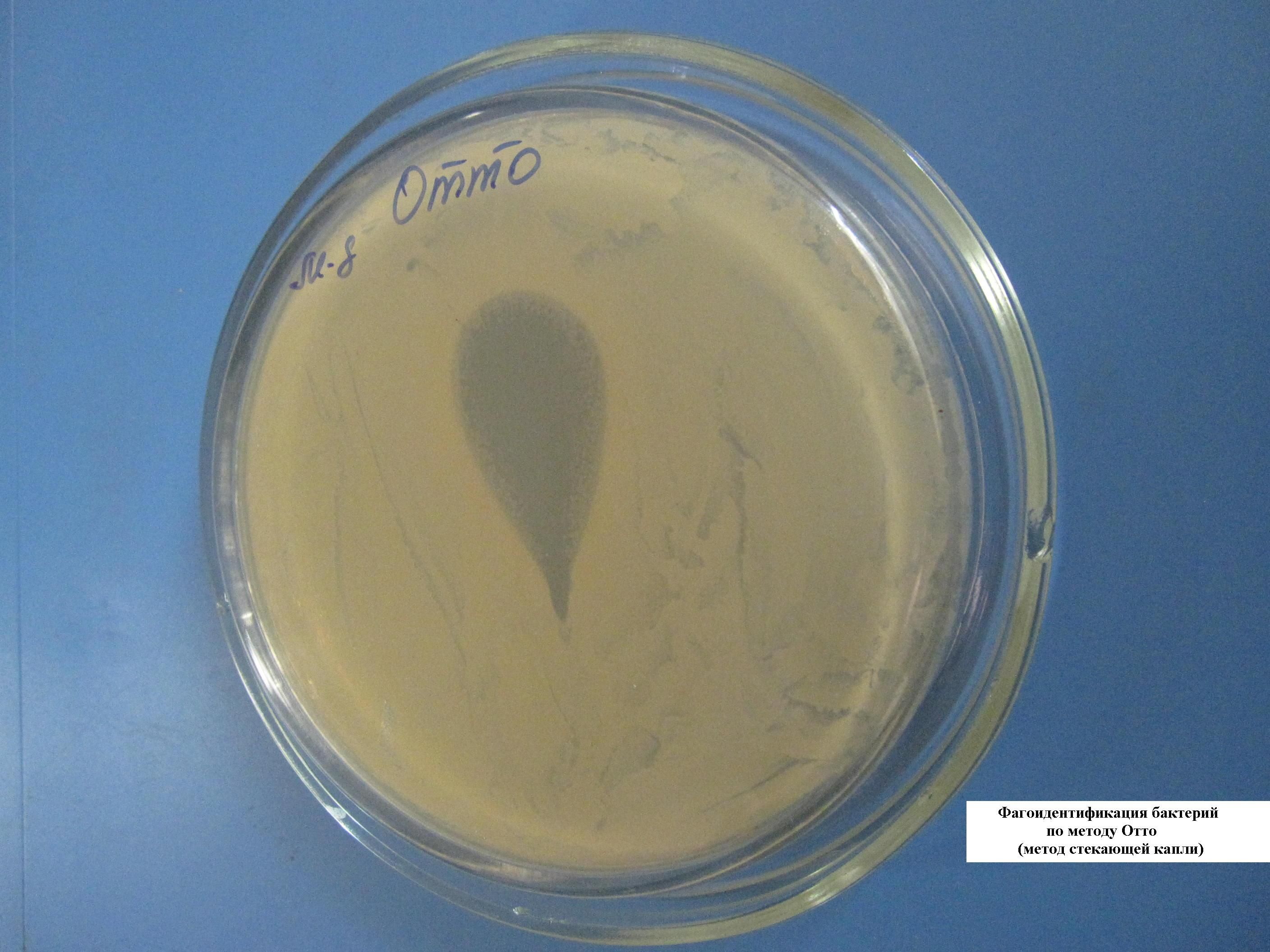
 СОВМЕСТНОЕ КУЛЬТИВИРОВАНИЕ АЭРОБОВ И АНАЭРОБОВ (МЕТОД ФОРТНЕРА)
СОВМЕСТНОЕ КУЛЬТИВИРОВАНИЕ АЭРОБОВ И АНАЭРОБОВ (МЕТОД ФОРТНЕРА)
В чашке с сахарным агаром вырезается «траншея» («ров») для невозможности миграции, смешивания разных культур бактерий. С одной стороны выполняется посев культуры аэробных бактерий, с другой – умеренно строгих анаэробов. Чашка закрывается, ее края запаиваются парафином (с целью не допустить попадания воздуха, кислорода внутрь чашки). Сначала вырастают в присутствии кислорода аэробы, а затем – анаэробы.
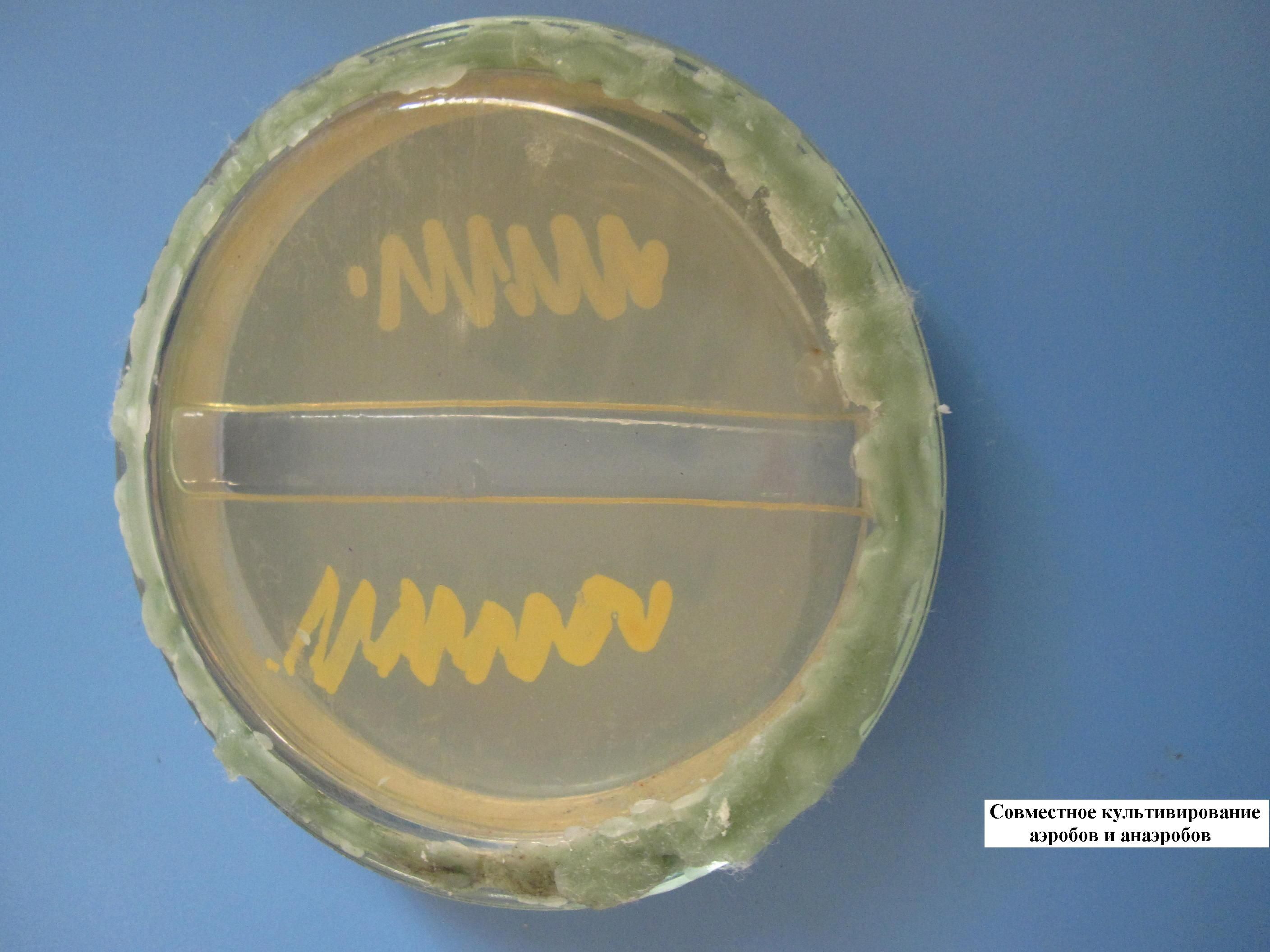
 ФАГОИДЕНТИФИКАЦИЯ БАКТЕРИЙ ПО МЕТОДУ ФЮРТА
ФАГОИДЕНТИФИКАЦИЯ БАКТЕРИЙ ПО МЕТОДУ ФЮРТА
В расплавленный и остуженный МПА (45-50 гр. С) добавляют определенный бактериофаг и выливают в чашку Петри. Чашка с полученным агаром делится на несколько секторов, в каждый из которых засеваются неизвестные культуры, выделенные от больных. Там, где культура соответствует бактериофагу, наблюдается отсутствие роста (лизис) бактерий.
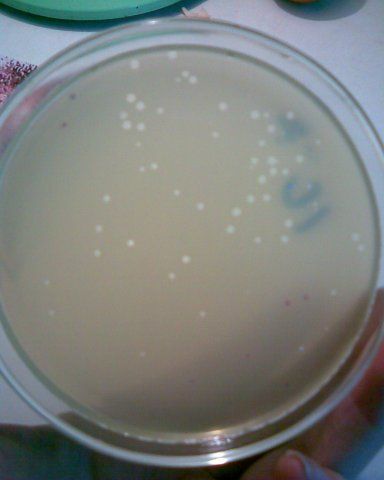 ТИТРОВАНИЕ БАКТЕРИОФАГА ПО МЕТОДУ ГРАЦИА
ТИТРОВАНИЕ БАКТЕРИОФАГА ПО МЕТОДУ ГРАЦИА
1,0 мл фага смешивают в пробирке с 0,5 мл бактериальной культуры и добавляют в эту же пробирку расплавленный МПА. Все содержимое выливают в чашку с МПА. Дают застыть верхнему тонкому слою и ставят в термостат. При встрече фага с бактерией, происходит лизис последней и образуется негативная колония фага. Такие негативные колонии затем подсчитывают для определения титра. Титром фага называют количество фаговых частиц в 1 мл препарата фага.
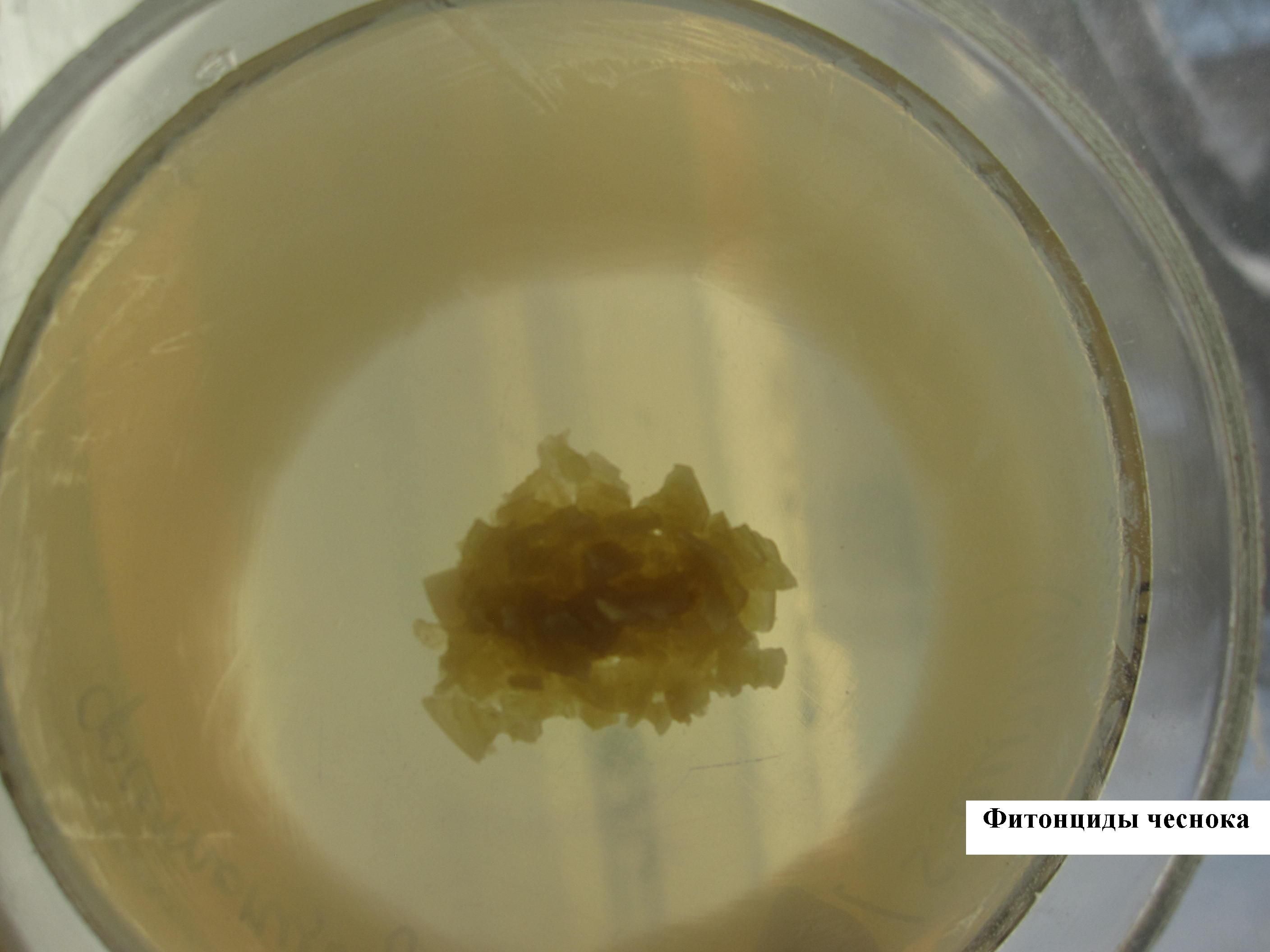 ОПЫТ ВЫЯВЛЕНИЯ ФИТОНЦИДОВ ЧЕСНОКА
ОПЫТ ВЫЯВЛЕНИЯ ФИТОНЦИДОВ ЧЕСНОКА
Чашку с МПА равномерно засевают шпателем суточной бульонной культурой бактерий (например, стафилококка). В центр посева помещают дольку чеснока, предварительно измельченного. Инкубируют в термостате. Через сутки отчетливо видна зона отсутствия роста вокруг измельченного чеснока (стерильная зона).
Источник
Для определения сахаролитических свойств микробов применяют дифференциально-диагностические среды такие, как среды Гисса, среда Эндо, среда Левина, среда Плоскирева.
Среды Эндо, Левина, Плоскирева в чашках Петри применяются для дифференцировки бактерий кишечной группы по способности сбраживать лактозу. Эти среды содержат питательный агар, лактозу и индикатор, изменяющий свой цвет в кислой среде (индикатор рН). Если посеять на такую среду бактерии, которые сбраживают лактозу, например, кишечную палочку, то в результате сбраживания лактозы образуется кислота, и индикатор изменит свой цвет в кислой среде. Поэтому колонии кишечной палочки на таких средах будут окрашены соответственно цвету индикатора: на среде Эндо и среде Плоскирева — в красный цвет, на среде Левина — в черно-синий. Если же на эти среды посеять бактерии, которые не сбраживают лактозу, например, палочки брюшного тифа или палочки дизентерии, то кислота не образуется, реакция среды останется слабощелочной и цвет индикатора не изменится. Поэтому колонии бактерий, не сбраживающих лактозу, на этих средах будут бесцветными
Среду Плоскирева можно отнести также и к элективным средам для выделения палочек дизентерии, так как эта среда содержит соли желчных кислот, задерживающих рост кишечной палочки, и краситель бриллиантовый зеленый, задерживающий рост воздушной кокковой микрофлоры.
Висмут-сульфит агар (ВСА) — это дифференциально-диагностическая среда, применяемая главным образом при диагностике сальмонеллезов. При росте сальмонелл происходит восстановление висмута из его солей и колонии сальмонелл окрашиваются в черный цвет.
Дифференциально-диагностические среды Гисса («пестрого» ряда) готовятся на основе жидкой среды (пептонной воды) или полужидкого мясопептонного агара. Содержат какой либо углевод или многоатомный спирт (лактозу, глюкозу, маннит, сахарозу) и индикатор, который меняет свой цвет в кислой среде. В пробирку с жидкой средой Гисса помещен стеклянный поплавок. Если на среду Гисса посеять микроб, который сбраживает данный углевод с образованием кислоты и газа, то есть до конечных продуктов, то среда изменит свой цвет, в полужидкой среде появятся пузырьки и разрывы в толще агара, в жидкой среде — пузырек газа в поплавке. При сбраживании углевода только до промежуточных продуктов (до кислоты) происходит только изменение цвета среды.
4. Методы изучения протеолитических и редуцирующих свойств бактерий.
Для определения протеолитической активности микробы засевают уколом в столбик желатина и после 3-5 суток инкубирования при комнатной температуре отмечают характер разжижения желатина: в виде воронки, гвоздя, чулка или в виде опрокинутой елки. Протеолитическую активность определяют также по образованию продуктов разложения белка: индола, сероводорода, аммиака. Для их определения засевают микроорганизмы в мясопептонный бульон, и между горлышком пробирки и ватной пробкой помещают индикаторные бумажки, исключая их контакт со средой. При образовании индола бумага, пропитанная насыщенным раствором щавелевой кислоты, приобретает розовый цвет; в присутствии сероводорода бумага, пропитанная ацетатом свинца, чернеет; при образовании аммиака красная лакмусовая бумажка синеет.
Для выявления редуцирующих свойств бактерий к обычным питательным средам (мясопептонному бульону, мясопептонному агару, молоку) добавляют соответствующие индикаторы (метиленовую синь, лакмус и др.).
Приводим несколько методов определения редуцирующих свойств.
1.) 5 мл молока с метиленовой синью засевают петлей исследуемой культуры, снятой с плотной питательной среды, или 1,0 мл 18-часовой бульонной культуры. После 24-часовой инкубации в термостате при 27° С отмечают результаты. При положительной реакции среда из голубой становится кремового цвета, а при слабой редукции приобретает зеленоватую окраску.
Молоко с метиленовой синью готовится следующим образом: свежее молоко доводят до кипения, оставляют в прохладном месте на сутки, освобождают его от сливок, затем вторично кипятят и через сутки вновь снимают верхний слой. Обезжиренное таким образом молоко фильтруют через толстый слой ваты, подщелачивают 10%-ным раствором углекислого натрия до pH 7,2. К 100 мл молока добавляют 2 мл 1%-ного водного раствора метиленовой сини. Приготовленную среду разливают по 5 мл в стерильные пробирки и стерилизуют текучим паром три дня подряд по 30 мин. После остывания среда имеет темно-голубой цвет. При наличии у бактерий редуцирующей способности метиленовая синь обесцвечивается и среда приобретает кремовый цвет.
2.) Определение редуцирующей способности бактерий на среде Омелянского производится следующим образом: к 100 мл щелочного мясопептонного агара добавляют десять капель стерильного свежеприготовленного 1%-ного водного раствора метиленовой сини. При посеве бактерий, обладающих редуцирующей способностью, среда обесцвечивается.
3.) На среде Ротбергера выявление редуцирующей способности бактерий состоит в следующем: к 100 мл расплавленного мясопептонного агара добавляют 0,3 г глюкозы и 1 мл насыщенного водорастворимого нейтраль-рота. Разливают в пробирки и дробно стерилизуют, затем среду охлаждают в вертикальном положении. Посев производят уколом. При наличии редуцирующей способности у бактерий цвет среды изменяется – из красного становится желтым (это становится хорошо заметным, если среду покрыть слоем жидкого парафина). При образовании газа в результате расщепления глюкозы агар растрескивается.
5. Использование ферментов (и ферментативной деятельности) микроорганизмов в медицине и биологии.
Для микробов характерна высокая ферментативная активность. Это используется в промышленности для получения органических кислот (уксусной, молочной, щавелевой, лимонной), приготовления молочных продуктов (сыр, ацидофилин, кумыс), в виноделии, пивоварении и других отраслях промышленности. Ферменты микробного происхождения – липазы и протеазы, входящие в состав моющих средств и стиральных порошков, расщепляют белковые и жировые загрязнения до водорастворимых веществ, которые легко смываются водой. В медицине находят применение такие лечебные средства, как стрептокиназа (фибринолизин стрептококков), террилитин (протеаза Aspergillus terricola). Так, во многих клиниках проводят измерение активности различных форм ферментов лактатдегидрогеназы и трансаминазы – их соотношение изменяется при таких болезнях как инфаркт миокарда, поражения печени, мышечные дистрофии; фермент стрептокиназу врачи применяют для рассасывания тромбов; ферменты трипсин и коллагеназа используются для рассасывания рубцов. С помощью ферментов получают витамины, гормоны, алкалозы, веществ, происходящих внутри клетки.
Рекомендуемые страницы:
Воспользуйтесь поиском по сайту:
Источник
На среде Эндо кишечная палочка образует круглые, выпуклые, гладкие колонии малиново-красного цвета с металлическим блеском. Среда Эндо — это дифференциально-диагностическая среда, которая кроме питательной основы, среда содержит 1% лактозу и насыщенный спиртовой раствор основного фуксина. Свежеприготовленная среда Эндо бесцветна или слегка розовая. При росте на этой среде кишечная палочка разлагает лактозу, образуются кислые продукты, они восстанавливают фуксин из бесцветного соединения в красный и поэтому вырастают колонии, окрашенные в малиново-красный цвет.
3. Изучить развёрнутую реакцию агглютинации с “живой” и “гретой” культурой при идентификации возбудителя колиэнтеритов.
Метод диагностики: бактериологический
Ингредиенты реакции: бактериальная суспензия (взвесь бактерий в физиологическом растворе), диагностические сыворотки, содержащие антитела к О55 и К11 антигенам, физиологический раствор.
Постановка: Диагностические сыворотки разводят в двух рядах, используя физиологический раствор. Для приготовления бактериальной суспензии добавить культуру с поверхности питательной среды в 3-5 мл физиологического раствора, разлить взвесь в 2 стерильные пробирки. Одну из них прогреть на водяной бане при 100°С в течение часа. В первый ряд добавляем несколько капель «живой» бактериальной суспензии, во второй ряд добавляем несколько капель бактериальной суспензии, «гретой» на водяной бане. Инкубируем в термостате 24 часа и учитываем результат.
Учет реакций агглютинации: Положительный результат — образование белого зонтика, отрицательный образование белой пуговки. Реакция считается положительной, если агглютинация с гретой культурой отмечается в разведении сыворотки не ниже половины титра сыворотки, а с живой не менее, чем 1:200 (диагностический титр реакции). Если реакция положительна, то выдают ответ в следующей формулировке “Выделена патогенная кишечная палочка серовара О55:К11.
Учесть биохимические свойства E. coli.
Ингредиенты: Среда Ресселя, которая содержит лактозу и глюкозу и пестрый ряд Гиса, состоящий из пяти углеводов. Кроме питательной основы и углевода к среде добавлен индикатор. Исходный цвет среды розовый, при образовании кислоты цвет среды становится синим. Газообразование улавливают с помощью поплавков-коротких стеклянных трубочек, запаянных с одного конца, помещенных в питательную среду, открытым концом вниз. Образование индола и сероводорода определено с помощью индикаторных бумажек. При образовании индола индикаторная бумажка, пропитанная насыщенным раствором щавелевой кислоты, розовеет. При образования сероводорода индикаторная бумажка, пропитанная уксуснокислым свинцом, чернеет.
Постановка: Пересев колоний со среды Ресселя на ряд Гиса и МПБ и инкубация 24 часа в термостате.
Биохимические изменения на пестром ряду с посевом кишечной палочки
| Лактоза | Глюкоза | Маннит | Мальтоза | Сахароза | МПБ | |
| Индол | Сероводород | |||||
| До кислоты и газа | До кислоты и газа | До кислоты и газа | До кислоты и газа | – | + | – |
Таким образом, для кишечной палочки характерна ферментация лактозы, глюкозы, мальтозы и маннита с образованием кислоты и газа, отсутствие ферментации сахарозы и образование индола.
Заполнить таблицу «Заболевания, вызываемые диареегенными E. сoli».
Решение ситуационных задач
III модуль «Кишечные инфекции»
Занятие № 2
ТЕМА: Микробиологическая диагностика дизентерии, брюшного тифа, паратифов А и В, сальмонеллезных гастроэнтеритов
ЦЕЛЬ ЗАНЯТИЯ: знать таксономию, основные свойства возбудителей, эпидемиологию, микробиологическую диагностику, принципы профилактики и лечения
уметь:учитывать характер роста на средах Эндо, Левина возбудителей дизентерии, ставить реакцию агглютинации на стекле, делать пересев на среду Ресселя, учитывать их биохимические свойства и реакцию агглютинации с парными сыворотками, реакцию Видаля
Задание на дом
1. Вопросы для самоподготовки:
1) Характеристика биологических свойств и особенности микробиологической диагностики дизентерии.
2) Характеристика биологических свойств и особенности микробиологической диагностики брюшного тифа, паратифов А и В.
3) Характеристика биологических свойств и особенности микробиологической диагностики сальмонеллёзных гастроэнтеритов.
Источник
