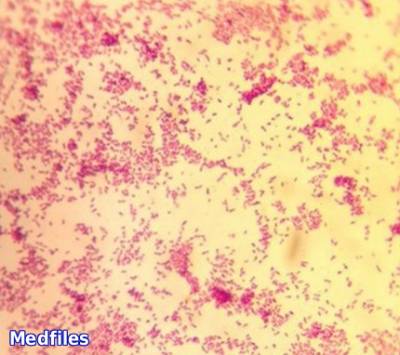
Кишечная палочка на кровяном агаре
Эшерихии (кишечная палочка)
История открытия.
Впервые были выделены из кишечника ребенка и описаны в 1885 г. немецким врачом-педиатром Теодором Эшерихом.
Таксономия. Семейство | Enterobacteriaceae |
Триба | Escherichieae |
Род | Escherichia |
Виды | E. сoli и другие, всего 5 видов |
Морфология и тинкториальные свойства.
E. сoli представляют собой грамотрицательные прямые с закругленными концами палочки размером 0,4-0,-2-6 мкм, в мазках располагаются беспорядочно, подвижные (перетрихи), имеют микрокапсулу, пили I и II типов, спор не образуют.
Культуральные свойства.
E.сoli – факультативные анаэробы, хемоорганогетеротрофы. Не требовательны к условиям культивирования. Оптимальные условия культивирования: температура 37 С, рН 7,2-7,5, длительность культивирования – 24-48 часа. Хорошо растут на простых питательных средах (МПБ, МПА). В МПБ наблюдается рост в виде диффузного помутнения с последующим образованием осадка. На МПА образуют колонии в S-форме: слабовыпуклые полупрозрачные колонии с ровными краями и гладкой, блестящей поверхностью среднего размера. Возможен рост в R-форме (колонии с изрезанными краями, шероховатой поверхностью), иногда вырастают слизистые колонии (М-форма).
Дают характерный рост на дифференциально-диагностических средах: Эндо (малиновые колонии с металлическим блеском); Левина (темно-синие колонии с металлическим блеском), Плоскирева (розовые колонии с металлическим блеском), Ресселя и Олькеницкого. На кровяном агаре могут давать гемолиз.
Биохимические свойства.
E. сoli обладают высокой ферментативной активностью. Каталазоположительны и оксидазоотрицательны. Реакция Фогеса-Проскауэра отрицательная. Разлагают сахара (глюкозу, лактозу, маннит, арабинозу, сахарозу и др.) до кислоты и газа. Разложение лактозы до кислоты и газа является отличительным признаком эшерихий от других энтеробактерий. Восстанавливают нитраты в нитриты, образуют индол, аммиак, не продуцируют сероводород, не разжижают желатин.
Антигенная структура.
Антигенная структура сложная. Имеются О-, Н-, К- (L, В, А), М-антигены, фимбриальные, рибосомные и многие другие антигены. При сероидентификации наибольшее значение имеют О-, Н-, К- антигены.
* О – соматический антиген, липополисахарид клеточной стенки, термостабильный, спиртоустойчивый, групповой (?171 серогруппа).
* Н – жгутиковый антиген, белок флагеллин , типовой (более 57 серотипов).
* К – капсульный антиген , кислый полисахарид, тоже типовой (более 97 серотипов). К-антиген не однороден – в зависимости от устойчивости к температуре выделяют 3 его разновидности :
– L – термолабильный антиген (разрушается при нагревании до 600С);
– А – термостабильный (выдерживает 2-3-часовое кипячение);
– В – промежуточный по термолабильности между А и L (выдерживает нагревание до 60С в течение часа, но разрушается при кипячении).
Серовары эшерихий обозначают с указанием антигенной формулы: О26:К60: Н2…
Факторы патогенности.
1. Токсины:
* эндотоксин – оказывает на организм человека пирогенное и токсическое (снижение АД, нейротоксичность) действие, подавляет фагоцитоз;
* экзотоксины образуют некоторые штаммы кишечной палочки:
– энтеротоскин (ЭТКП);
– цитотоксин с гемолитическим и некротическим действием (ЭИКП, ЭГКП).
2. Структурные и химические компоненты клетки:
* пили I (адгезия) и II (конъюгация) типов;
* капсула и Т-белок клеточной стенки (адгезия, подавление фагоцитоза);
* плазмиды (у E. сoli обнаружены Col-, R-, F-, Hly-, Ent-плазмиды, а также плазмиды, кодирующие синтез факторов адгезии).
Резистентность.
E. сoli обладают хорошей выживаемостью во внешней среде, сохраняются в почве и воде несколько месяцев. При 56С гибнут в течении 1 часа, нагревание до 60С выдерживают не более 15-20 мин, при кипячении погибают мгновенно. Чувствительны к дезинфицирующим средствам и антибиотикам.
Экология и роль в патологии.
Различают условно-патогенные и диареегенные E. сoli.
Условно-патогенные E. сoli входят в состав микрофлоры кишечника человека, млекопитающих, птиц, рептилий и рыб. С испражнениями E. сoli выделяются в окружающую среду. Кишечная палочка является санитарно-показательным микроорганизмом, ее обнаружение свидетельствует о свежем фекальном загрязнении объектов внешней среды.
Условно-патогенные E. сoli вызывают эндогенные гнойно-воспалительные процессы различной локализации (инфекции мочевыводящих путей, нагноение ран, холецистит, аппендицит, перитонит, конъюктивит, отит, пневмонии, менингиты…) вплоть до сепсиса, чаще на фоне ИДС.
Диареегенные E. сoli являются возбудителями экзогенных инфекций – эшерихиозов (острые кишечные заболевания, протекающие по типу энтеритов и энтероколитов) и пищевые отравления.
Эпидемиология.
Заболевания, вызванные E. сoli, распространено повсеместно.
Источник инфекции: больные и бактерионосители.
Механизм передачи: фекально-оральный (пути: пищевой, контактно-бытовой и реже водный).
Патогенез и клинические проявления.
Диареегенные серовары кишечной палочки разделены на 5 групп:
* Энтеропатогенные (ЭПКП);
* Энтеротоксигенные (ЭТКП);
* Энтероинвазивные (ЭИКП);
* Энтерогеморрагические (ЭГКП);
* Энтероадгезивные (ЭАКП).
Кроме вышеперечисленных выделяют диффузноприлипаемые кишечные палочки (пока недостаточно изучены).
Морфологически представители разных групп не отличимы друг от друга; их дифференцируют по антигенной структуре и по факторам патогенности.
ЭПКП – вызывают эшерихиозы у детей до 1 года (чаще у детей, находящихся на искусственном вскармливании). Возбудители поражают эпителий тонкого кишечника: адсорбируясь на поверхности энтероцитов за счет белка наружной мембраны (интимина), размножаются здесь и повреждают микроворсинки, вызывая их отторжение. Развивающаяся при этом воспалительная реакция обусловлена действием эндотоскина, который освобождается при разрушении кишечных палочек. Основные клинические проявления: диарея, рвота, срыгивание пищи, признаки обезвоживания организма, гипотрофия. Течение болезни – тяжелое, может длиться неделями.
ЭТКП вызывают холероподобные заболевания у детей и взрослых. При помощи пилей они прикрепляются к эпителию нижних отделов тонкого кишечника, размножаются благодаря CF (фактор колонизации) и продуцируют 2 типа токсинов: LT (термолабильный, по механизму действия напоминает экзотоксин холерного вибриона) и ST (термостабильный). LT и ST увеличивают в клетках эпителия содержание цАМФ и цГМФ соответственно, что вызывает нарушение транспорта молекулярного железа и повышенному выходу воды из клеток. Это нарушает водно-солевой баланс в кишечнике и приводит к развитию водянистой диареи. Заболевание по характеру течения напоминает легкую форму холеры (в литературе его часто называют диареей путешественников).
ЭИКП вызывают дизентериеподобное заболевание у детей и взрослых. Адсорбируются на клетках эпителия нижних отделов толстой кишки, проникают внутрь клеток, размножаются, выделяют шигеллоподобный токсин и разрушают клетки. Распространяясь по межклеточным пространствам, они поражают соседние клетки, образуя язвы. Клинические симптомы: вначале – водянистая диарея, затем в испражнениях появляется примесь слизи и крови.
ЭГКП – возбудители геморрагической диареи и гемолитического уремического синдрома, поражая преимущественно детей. Возбудители выделяют шигелоподобный цитотоксин, вызывающий разрушение эндотелия сосудов (блокирует синтез белков на рибосомах) кишечника и почек, в результате чего развиваются ишемия и некроз клеток. Клинически наблюдается геморрагический колит (кровавый понос) и гемолитический уремический синдром (гемолитическая анемия и почечная недостаточность), которые протекают тяжело и нередко с летальным исходом.
ЭАКП (описаны в 1985 г.у) способны быстро прикрепляться к поверхности клеток и колонизировать разные отделы кишечника, но чаще поражают толстую кишку. Цитотоксинов они не образуют, в клетки не проникают. Клинически заболевание характеризуется упорным диарейным синдромом.
Иммунитет.
После перенесения эшерихиозов формируется гуморальный типоспецифический иммунитет, наблюдается выработка местного иммунитета (SIgA). Образующие антитела не обладают протективными свойствами.
У детей первого года жизни пассивный трансплацентарный иммунитет обеспечивается проходящими через плаценту антителам и антителам, поступающими с материнским молоком. Также с женским молоком передаются и мукополисахариды, способствующие размножению лакто- и бифидобактерий – антагонистов возбудителей эшерихиозов.
Микробиологическая диагностика.
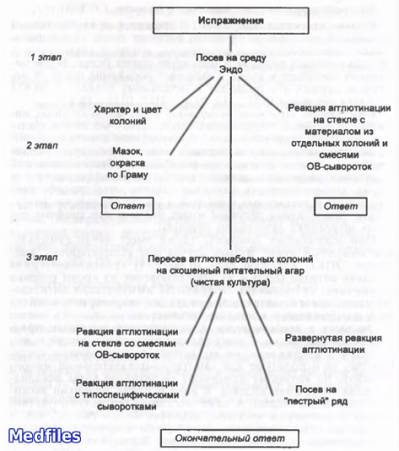
Исследуемый материал: при кишечных эшерихиозах – испражнения, рвотные массы, у грудных детей мазки из зева, при эндогенной инфекции – материал из соответствующего очага (моча, отделяемое раны, кровь…).
1. Бактериоскопический метод.
2. Бактериологичекий метод (основной) – выделение чистой культуры возбудителя, ее идентификация, определение чувствительности к антибиотикам.
3. Серологический метод:
* РА с поли-(ОВ) и моновалентными агглютинирующими эшерихиозными сыворотками;
* ИФА;
* РИФ.
4. Молекулярно-биологический метод (ПЦР, ДНК-зонды).
Специфическая профилактика не разработана.
Неспецифическая профилактика: ранняя диагностика, изоляция больных, регулярное профилактическое обследование работников детских учреждений и ЛПУ. Большое значение имеет строгое соблюдение санэпидрежима в этих учреждениях.
Принципы терапии: диета, ХТП (нитрофураны, фторхинолоны), при генерализованных формах – антибиотики с учетом чувствительности, спецефическое лечение – коли-бактериофаг, лакто- и бифидосодержащие пробиотики.
Источник
Оглавление темы “Эшерихии. Эшерихиозы. Кишечная палочка. Шигеллы. Дизентерия.”:
1. Диагностика энтеробактерий. Выявление энтеробактерий. Диагностические подходы для энтеробактерий.
2. Эшерихии. Эшерихиозы. Свойства эшерихий. Кишечная палочка. Escherichia coli. Морфология кишечной палочки. Культуральные свойства кишечной палочки.
3. Биохимические свойства кишечной палочки. Антигены кишечной палочки. Антигенная структура кишечной палочки. Серовары кишечной палочки.
4. Патогенез поражений кишечной палочкой. Клинические проявления коли инфекции. Кишечные инфекции ( коли-инфекции ). Энтеротоксигенные кишечные палочки.
5. Энтероинвазивные кишечные палочки. Энтеропатогенные эшерихии. Энтерогеморрагические кишечные палочки.
6. Энтероадгезивные кишечные палочки. Уропатогенные эшерихии. Инфекции мочевыводящих путей вызванные кишечной палочкой. Бактериемия эшерихий.
7. Менингит вызванный кишечной палочкой. Респираторные инфекции вызванные эшерихиями ( кишечной палочкой ).
8. Микробиологическая диагностика кишечной палочки. Диагностика кишечной палочки. Выявление эшерихий.
9. Лечение эшерихиозов. Лечение кишечной инфекции. Профилактика эшерихиозов. Профилактика кишечной инфекции.
10. Шигеллы. Дизентерия. Бактериальная дизентерия. Шигеллез. История дизентерии. Серовары шигелл. Серовары возбудителей дизентерии.
Эшерихии. Эшерихиозы. Свойства эшерихий. Кишечная палочка. Escherichia coli. Морфология кишечной палочки. Культуральные свойства кишечной палочки.
Своё название бактерии получили в честь немецкого педиатра Т. Эшериха, впервые выделившего Escherichia coli из содержимого кишечника детей. Род образуют подвижные (перитрихи) прямые палочковидные бактерии размером 1,1-1,5×2,0-6,0 мкм. В мазках они располагаются одиночно или парами. У большинства штаммов существуют капсулы или микрокапсулы.
Температурный оптимум для роста эшерихий 37 °С. Эшерихии ферментируют углеводы с образованием кислоты или кислоты и газа, оксидаза-отрицательны и каталаза-положительны.
Эшерихии входят в состав микрофлоры толстой кишки теплокровных, пресмыкающихся, рыб и насекомых. Эшерихии — основная аэробная микрофлора кишечника, вызывающая, однако, обширную группу заболеваний человека, известных как эшерихиозы.
Эшерихиозы характеризуются не только клиническим полиморфизмом, но и создают особую эпидемиологическую ситуацию. Основное медицинское значение имеет кишечная палочка (Escherichia coli). Кишечные палочки рассматривают как санитарно-показательные микроорганизмы (СПМ) при анализе воды и пищевых продуктов.

Кишечная палочка. Escherichia coli
В настоящее время среди прочих энтеробактерии кишечная палочка — основной возбудитель эшерихиозов у человека.
Морфология кишечной палочки. Культуральные свойства кишечной палочки
Кишечная палочка имеют типичную для энтеробактерий форму и представлены короткими подвижными палочками с закруглёнными концами.
• На плотных средах бактерии образуют плоские выпуклые мутные S-колонии с ровными или слегка волнистыми краями (3-5 мм в диаметре) либо сухие плоские R-колонии с неровными краями.
• В жидких средах растут диффузно, вызывая помутнение среды и образование осадка (реже формируют поверхностную плёнку или пристеночное кольцо).
• На средах Хисса кишечная палочка может образовывать газ. На селективно-дифференциальных средах колонии принимают цвет, соответствующий окраске среды. На агаре Эндо лактоза-положительные эшерихии образуют фукс и ново-красные колонии с металлическим блеском, лактоза-отрицательные — бледно-розовые или бесцветные с тёмным центром. На среде Левина бактерии формируют тёмно-синие колонии с металлическим блеском, а лактоза-отрицательные — бесцветные, на среде Плоскирева — соответственно красные с жёлтым оттенком или бесцветные. На КА могут давать полный гемолиз.
– Также рекомендуем “Биохимические свойства кишечной палочки. Антигены кишечной палочки. Антигенная структура кишечной палочки. Серовары кишечной палочки.”
Источник
План ответа макропрепарата.
- Название
- Ингредиенты
- Назначение
- Наблюдаемый результат
- Рост кишечных палочек на среде Эндо.
Среда Эндо – дифференциально-диагностическая среда. В составе среды: лактоза и индикатор кислотности – фуксин. Среда предназначена для выделения (преимущественно из кала и мочи) и дифференциации микроорганизмов семейства Enterobacteriaceae. Лактозопозитивные кишечные палочки, входящие в состав нормальной микрофлоры кишечника растут колониями малиново-красного цвета с металлическим блеском, так как расщепляют лактозу и изменяют рН среды. Лактозоотрицательные микроорганизмы (некоторые патогенные кишечные палочки, шигеллы, сальмонеллы) растут колониями белого или светло-розового цвета.
- Рост кишечных палочек и дизентерийных палочек на среде Плоскирева.
Среда Плоскирева – дифференциально-диагностическая среда. Это селективная среда для выделения шигелл и сальмонелл. Готовая среда прозрачна, имеет розовато-желтоватый цвет. Среда Плоскирева относится к плотным средам для выделения чистых культур. В состав среды Плоскирева входят ингибирующие вещества (желчные соли, бриллиантовый зеленый, йод), вследствие чего она должна полностью подавлять рост грамположительной флоры, значительно задерживать (первые 24 ч) рост эшерихий и другой сопутствующей микрофлоры, подавлять роение протея. Дифференцирующие свойства агара Плоскирева основаны на изменении рН в кислую сторону при росте лактозоферментирующих бактерий, которые образуют колонии брусничного цвета (индикатор нейтральный красный). Лактозоотрицательные бактерии вырастают в виде бесцветных или слабоокрашенных колоний.
Реакция непрямой (пассивной) гемагглютинации (РНГА).
Эта реакция относится к серологическим реакциям иммунитета между антигенами (АГ) и антителами (АТ). Детерминанта АГ связывается с активным центром АТ. Соединение АГ и АТ осуществляется посредством водородных и гидрофобных связей, взаимодействия ионов, кулоновских и ван-дер-вальсовых сил. Прочность соединения АГ с АТ обеспечивается не только силами связывания, но и оптимальной стерической адаптацией активного центра АТ к АГ-детерминанте.
Серологические реакции протекают в две фазы. Первая – специфическая невидимая, – заключается во взаимодействии АГ с АТ. Вторая фаза – видимая, – проявляется в зависимости от типа реакции, который определяется свойствами АГ, АТ и другими ингридиентами реакций.
Реакция непрямой гемагглютинации (РНГА; син. реакция пассивной гемагглютинации) – метод обнаружения и идентификации антигенов или антител, основанный на возникающем в их присутствии феномене агглютинации эритроцитов, на поверхности которых были предварительно адсорбированы соответствующие специфические антитела или антигены.
Серологический метод. Сыворотка крови обследуемого пациента (содержит неизвестные (искомые) АТ). Эритроцитарный диагностикум – содержит известный антиген, адсорбированный на поверхности эритроцита. Образование комплекса АГ-АТ влечет за собой и склеивание эритроцитов, что легко учитывать. Таким образом, эритроциты не участвуют непосредственно в образовании комплекса АГ-АТ, служат для укрупнения корпускула и соответственно являются индикаторами наличия комплекса АГ-АТ. РНГА более чувствительна, чем РА.
РНГА может использоваться как экспресс-метод, например при диагностике чумы или газовой гангрены. Ингредиенты: исследуемый материал – неизвестный АГ, диагностикум эритроцитарный антительный (содержит известные АТ адсорбированные на поверхности эритроцита). Образование комплекса АГ-АТ влечет за собой и склеивание эритроцитов, что легко учитывать.
Определения чувствительности бактерий к антибиотикам методом индикаторных дисков.
Важное значение в лечении и профилактике инфекционных заболеваний принадлежит химиотерапии и химиопрофилактике, эффективность которых в значительной степени зависит от чувствительности микроорганизмов к антимикробным препаратам. Среди химиотерапевтических средств, используемых для лечения больных с гнойно-септическими инфекциями, ведущее место занимают антибиотики.
Для определения чувствительности выделенных микроорганизмов к антибиотикам широко используется диско-диффузионный метод. Исследуемую культуру суспензируют в стерильном физиологическом растворе приготовляя 1-миллиардную взвесь по стандарту мутности. Бактериальную взвесь (1 мл) стерильной пипеткой наливают на поверхность плотной питательной среды в чашку Петри и равномерно распределяют шпателем. Избыток жидкости удаляют пипеткой. Шпатель и пипетки помещают в стакан с дезраствором. На засеянную поверхность стерильным пинцетом помещают на одинаковом расстоянии друг от друга и отступя 2 см от края чашки бумажные диски, содержащие определенные дозы разных антибиотиков. Посевы инкубируют при 37°С до следующего дня. По диаметру зон задержки роста исследуемой культуры бактерий судят о ее чувствительности к антибиотикам. Для получения достоверных результатов необходимо применять стандартные диски и питательные среды, для контроля которых используются эталонные штаммы соответствующих микроорганизмов. Метод дисков не дает надежных данных при определении чувствительности микроорганизмов к плохо диффундируюшим в агар полипептидным антибиотикам (например, полимиксин, ристомицин).
Персистентные свойства микроорганизмов – антилизоцимная активность (АЛА).
АЛА – секреторный фактор персистенции. Изучают АЛА по методике О.В. Бухарина с соавт. (1984). Для этого к 1,5% питательному агару добавляют различные дозы яичного лизоцима (от 1 до 5 мкг) и разливают в чашки Петри. После застывания среды на подсушенную поверхность наносят каплю 1 млрд. взвеси суточной агаровой культуры изучаемого микроорганизма. Чашки инкубируют в термостате при 370С 24 часа, после этого выросшие колонии подвергаются обработке парами хлороформа в течение 20 минут, затем наслаивается слой 0,7% питательного агара с 0,1 мл 1 млрд. взвеси суточной агаровой культуры Micrococcus luteus (lysodeikticus) АТСС 15307 (ГИСК им. Тарасевича) чувствительной к литическому действия лизоцима. Учет результатов проводится через 24 часа инкубации в термостате по наличию зоны роста микрококка вокруг тех штаммов, которые нейтрализуют внесенный в слой агара яичный лизоцим. Антилизоцимную активность выражают в мкг инактивированного в среде лизоцима.
На данной чашке видны колонии АЛА+ и АЛА- штаммов микроорганизмов. Над колониями АЛА+ штаммов есть рост микрококка в виде мелких желтых колоний.
Лизоцимная активность.
Лизоцим –термостабильный белок, фермент, разрушает клеточную стенку преимущественно грамположительных бактерий, разрывая β-гликозидные связи между аминосахарами пептидогликана, что способствует образованию протопластов с последующим их лизисом. Содержится во всех тканевых жидкостях, в лейкоцитах, макрофагах и других фагоцитирующих клетках. Продуцируется лизоцим преимущественно клетками моноцитарно/макрофагального ряда. Лизоцим усиливает антибактериальную активность комплекса антиген (микроб)-антитело-комплемент, способствуя лизису пептидогликана клеточной стенки бактерий. Помимо животного раличают растительный и микробный лизоцим.
Микробный лизоцимявляется одним из факторов колонизации. Лизоцимная активность (ЛА) определяется путем посева исследуемой культуры микроорганизма на питательную среду, содержащую 1 млрд. суспензию суточной агаровой культуры Micrococcus luteus (lysodeikticus) АТСС 15307 (ГИСК им. Тарасевича). Результат оценивается после инкубации при 370С в течение суток по зоне лизиса в толще среды индикаторного штамма микрококка вокруг изучаемых колоний.
Иммуноферментный метод
Иммуноферментный анализ (сокращённо ИФА, англ. enzyme-linked immunosorbent assay, ELISA) — лабораторный иммунологический метод качественного или количественного определения различных соединений, макромолекул, вирусов и пр., в основе которого лежит специфическая реакция антиген-антитело. Выявление образовавшегося комплекса проводят с использованием фермента в качестве метки для регистрации сигнала.
ИФА появился в середине 60-х годов и первоначально был разработан как метод для идентификации антигена в гистологическом препарате, а также для визуализации линий преципитации в тесте иммунодифузии и иммуноэлектрофореза, а затем стал использоваться для количественного определения антигенов и антител в биологических жидкостях. В разработке метода принимали участия Е. Энгвалл и Р. Пэлман, а также независимо от них В. Ван Вееман и Р. Шурс.
Метод основан на специфическом связывании антитела с антигеном, при этом один из компонентов конъюгирован с ферментом, в результате реакции с соответствующим хромогенным субстратом образовывается окрашенный продукт, количество которого можно определить спектрофотометрически.
Открытие возможности иммобилизации антигена и антитела на различных носителях с сохранением их связывающей активности позволило расширить использование ИФА в различных областях биологии и медицины.
Появление моноклональных антител послужило дальнейшему развитию ИФА, что позволило повысить его чувствительность, специфичность и воспроизводимость результатов.
Теоретически ИФА основывается на данных современной иммунохимии и химической энзимологии, знании физико-химических закономерностей реакции антиген-антитело, а также на главных принципах аналитической химии. Чувствительность ИФА и время его проведения определяется несколькими основными факторами: кинетическими, термодинамическими характеристиками реакции антиген-антитело, соотношением реагентов, активностью фермента и разрешающей способностью методов его детекции. В общем виде реакция антиген-антитело может быть описана простой схемой: [AT]+[АГ]↔[АТАГ]
Разнообразие объектов исследования от низкомолекулярных соединений до вирусов и бактерий, а также необычайно широкий круг задач, связанных с многообразием условий применения ИФА, обусловливают разработку чрезвычайно большого количество вариантов этого метода.
Любой вариант ИФА содержит 3 обязательные стадии:
1. стадия узнавания тестируемого соединения специфическим к нему антителом, что ведет к образованию иммунного комплекса;
2. стадия формирования связи конъюгата с иммунным комплексом или со свободными местами связывания;
3. стадия превращения ферментной метки в регистрируемый сигнал.
Принципальная схема иммуноферментного анализа для выявления АТ является следующей. Известный АГ (вирус, белок) – диагностикум фиксируется на твердой фазе. К нему добавляют сыворотку обследуемого с неизвестными АТ. После инкубации и промывки на антигене остаются специфичные к нему АТ, если таковые имелись в сыворотке обследуемого. Для обнаружения комплекса АГ-АТ, к нему добавляют кроличью антиглобулиновую сыворотку меченую ферментом (АГС-Ф). Для получения данной сыворотки иммунизируют кролика глобулинами человека. Полученную от кролика сыворотку метят каким-либо ферментом, например, пероксидазой хрена. Если в обследуемой сыворотке есть АТ к АГ (диагностикум), то они будут служить антигеном для антиглобулиновой сыворотки. После второй промывки образовавшийся комплекс АГ+АТ+АГС-Ф можно обнаружить, добавив субстрат на фермент (перекись водорода) и индикатор на продукты расщепления субстрата (хромоген на активные формы кислорода). Изменение цвета индикатора свидетельствует о наличии искомых АТ в сыворотке обследуемого.
Среда Китта-Тароцци.
Питательный бульон с глюкозой и кусочками свежих органов животных. Глюкоза и кусочки органов обладают редуцирующей способностью. Сверху среду заливают слоем стерильного масла, которые не пропускает кислород из воздуха в среду. В результате создаются условия для культивирования анаэробных микроорганизмов.
План ответа макропрепарата.
- Название
- Ингредиенты
- Назначение
- Наблюдаемый результат
- Рост кишечных палочек на среде Эндо.
Среда Эндо – дифференциально-диагностическая среда. В составе среды: лактоза и индикатор кислотности – фуксин. Среда предназначена для выделения (преимущественно из кала и мочи) и дифференциации микроорганизмов семейства Enterobacteriaceae. Лактозопозитивные кишечные палочки, входящие в состав нормальной микрофлоры кишечника растут колониями малиново-красного цвета с металлическим блеском, так как расщепляют лактозу и изменяют рН среды. Лактозоотрицательные микроорганизмы (некоторые патогенные кишечные палочки, шигеллы, сальмонеллы) растут колониями белого или светло-розового цвета.
- Рост кишечных палочек и дизентерийных палочек на среде Плоскирева.
Среда Плоскирева – дифференциально-диагностическая среда. Это селективная среда для выделения шигелл и сальмонелл. Готовая среда прозрачна, имеет розовато-желтоватый цвет. Среда Плоскирева относится к плотным средам для выделения чистых культур. В состав среды Плоскирева входят ингибирующие вещества (желчные соли, бриллиантовый зеленый, йод), вследствие чего она должна полностью подавлять рост грамположительной флоры, значительно задерживать (первые 24 ч) рост эшерихий и другой сопутствующей микрофлоры, подавлять роение протея. Дифференцирующие свойства агара Плоскирева основаны на изменении рН в кислую сторону при росте лактозоферментирующих бактерий, которые образуют колонии брусничного цвета (индикатор нейтральный красный). Лактозоотрицательные бактерии вырастают в виде бесцветных или слабоокрашенных колоний.
Рост стафилококка на кровяном агаре.
Кровяной агар (КА) – сложная плотная питательная среда для культивирования прихотливых видов микроорганизмов и выявления гемолизинов (определения у МО одного из факторов вирулентности – гемолитической активности). На 100 мл расплавленный и остуженный до 450С мясо-пептонный агар (МПА) добавляют 5 мл отмытых эритроцитов барана или эритроцитарной массы крови человека (I группы), аккуратно перемешивают, разливают в чашки Петри. На поверхность застывшего и подсушенного КА засевают чистую культуру исследуемых микроорганизмов, после суточной инкубации при 370С определяют зоны гемолиза вокруг выросших колоний. Зоны гемолиза виды в виде полного (β-гемолиз) или частичного (α-гемолиз) просветления вокруг колоний. На данной чашке видны колонии стафилококков бело-серого цвета с зонами полного просветления вокруг, что свидетельствует о наличии у этих микроорганизмов гемолитической активности.
4. Реакция преципитации в агаре для определения токсигенности дифтерийной палочки.
Реакция преципитации относится к реакции иммунитета между антигенами (АГ) и антителами (АТ). Детерминанта АГ связывается с активным центром АТ. Соединение АГ и АТ осуществляется посредством водородных и гидрофобных связей, взаимодействия ионов, кулоновских и ван-дер-вальсовых сил. Прочность соединения АГ с АТ обеспечивается не только силами связывания, но и оптимальной стерической адаптацией активного центра АТ к АГ-детерминанте.
Серологические реакции протекают в две фазы. Первая – специфическая невидимая, – заключается во взаимодействии АГ с АТ. Вторая фаза – видимая, – проявляется в зависимости от типа реакции, который определяется свойствами АГ, АТ и другими ингридиентами реакций. В реакции преципитации (РП) участвует растворенный антиген. При контакте с антителами – преципитинами образуется осадок. Реакцию преципитации можно проводить в жидкой среде (в пробирках) и в геле (в чашках Петри).
Одной из разновидностей РП в геле является реакция определения токсигенности дифтерийной палочки. Для этого в чашку Петри на питательную среду помещают полоску стерильной фильтровальной бумаги, пропитанную антитоксической противодифтерийной сывороткой. Эта сыворотка содержит АТ к дифтерийному токсину, получается путем иммунизации животного (кролика) анатоксинами (токсин лишенный вирулентности-токсигенности, но сохранивший иммуногенность-антигенность). Затем на плотнуб питательну среду в чашке высевают испытуемые культуры в виде пятачков на расстоянии 0,6-0,8 см от края фильтровальной бумаги. Чашки инкубируют при 370С в течение суток. При наличии токсигенной культуры в месте взаимодействия токсина с антитоксином образуются линии преципитации в виде дуг. Дуга – это визуальное отображение взаимодействия АТ диффундирующих из фильтровальной бумаги и АГ – экзотоксинов, выделяемых токсигенными культурами.
Источник
