Кишечная палочка окраска по граму фото
Данный метод окраски является базовым в микробиологии, т.к. на его основе бактерии классифицируются на две большие группы – грамположительные и грамотрицательные. Основой данного подразделения бактерий является их отношение к даннной окраске. Изначально бактерии не имеют цвета, т.е. прозрачны. Но за счет различного строения своих оболочек они по-разному воспринимают тот или иной краситель. И данное свойство воспринимать окраску – строго врожденное, видовое и практически неизменное. Поэтому такое свойсво бактерий (свойство восприятия краски) и легло в основу их классификации. Деление бактерий на грамположительных и грамотрицательных можно встретить, например, в любой инструкции к антибиотикам.
При классической окраске по Граму чаще применяются такие компоненты: карболовый раствор генцианового фиолетового, карболовый раствор фуксина, раствор Люголя, спирт этиловый. Концентрированный карболовый фуксин называется еще фуксин Циля, разведенный водой – фуксин Пфейфера. Все наименования компонентов по фамилиям ученых (как и собственно само название метода: по Граму).
Методика проведения окрашивания.
Предметное стекло перед исследованием обезжиривают и делают на нем мазки исследуемых культур. Мазки следует делать тонкими, чтобы клетки равномерно распределялись на поверхности стекла и не образовывали скоплений. Препарат высушивают при температуре 20-22 0C, фиксируют над пламенем горелки (спиртовки).
1. На фиксированный мазок нанести раствор генцианового фиолетового на 1-2 мин.
2. Не промывая водой, нанести на препарат раствор Люголя и выдержать 1 мин – до полного почернения мазка.
3. Раствор Люголя слить и обесцветить мазок 70% спиртом этиловым, несколько раз наливая его на предметное стекло и покачивая стекло. Процесс обесцвечивания считается завершенным, когда от мазка перестают отделяться окрашенные в фиолетовый цвет струйки жидкости (но не более 30 сек.).
4. Препарат промыть водой.
5. На препарат нанести на 1-2 мин раствор карболового фуксина, разведенного 1:9 водой (фуксин Пфейфера).
6. Краску слить, препарат промыть водой, осушить фильтрованной бумагой или высушить на воздухе, и микроскопировать с иммерсионной системой.
Грамположительные микроорганизмы окрашиваются в сине-фиолетовый цвет, грамотрицательные – в красный. Поэтому основополагающим здесь является результат окраски – цвет. По инструкции все бактерии красятся одними и теми же красителями, а в итоге получается разный цвет. Почему? Все заключается в строении клеточной стенки. У одних бактерий она толстая, и поэтому глубоко прокрашивается фиолетовым красителем, не воспринимая уже последующий краситель. Это будут грамположительные бактерии. А у других клеточная стенка тонкая. Первым красителем она так же окрашивается, но потом вымывается спиртом и докрашивается вторым красителем.
Набор для классической окраски по Граму
Если схематично описать метод, то происходит следующее:
– окраска бактерий в фиолетовый цвет (генциановым фиолетовым) – все бактрии становятся фиолетовыми;
– прочная связь красителя в толще оболочки с молекулами йода (при добавлении раствора Люголя) – мазок приобретает бурый цвет;
– обесцвечивание тонкостенных бактерий этиловым спиртом (вымывание красителя из оболочки) – толстостенные бактерии остаются фиолетовыми, тонкостенные становятся бесцветными;
– докрашивание в красный цвет – толстостенные бактерии остаются фиолетовыми, тонкостенные перекрашиваются в красный цвет.
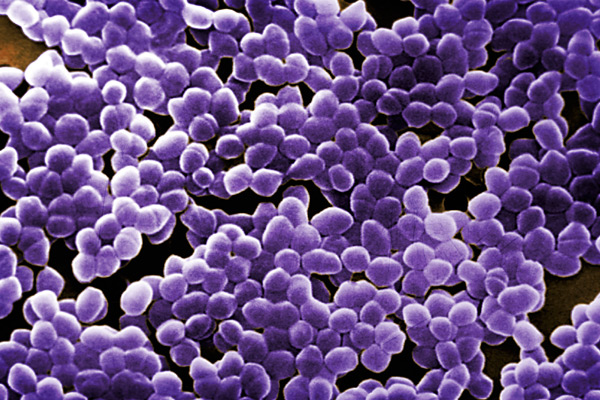
Грамположительные кокковые колонии. Увеличение 1000х.
Помимо классической методики существует и множество модификаций: модификация по Эткинсу, по Калине, по Синеву, по Николля и др. Суть практически везде сохраняется, но немного изменена сама методика окрашивания, либо заменены красители на другие. Например, фуксин часто заменяется на 2% раствор сафранина. Это вносит определенное удобство в работу, т.к. разведенный водой фуксин (фуксин Пфейфера) не очень стоек (хранится 1-2 суток), и приходится каждый раз готовить свежий раствор, а раствор сафранина не требует разведения и используется без подготовки.
Примечательна методика окраски по Граму в модификации по Синеву. Специфика окраски заключается в том, что вместо растворов красителей используются кусочки фильтровальной бумаги, которые заранее пропитываются данными расворами и высушиваются. Окраска происходит при наложении сухой окрашенной бумажки на мазок и нанесении капли воды на бумажку. Бумага мгновенно пропитывается и краситель вымывается на мазок.
Набор для окраски по Граму в модификации по Синеву
Какие возможные ошибки бывают при окраске по Граму и как с ними не столкнуться?
Чаще это ошибки технического характера.
1. Все бактерии в итоге грамположительные. Такое действительно бывает, когда, например, в мазок попали колонии стрептококков, стафилококков и др. (они по природе практически все грамположительные). Но если рассматривать с позиции ошибки, то это случается, когда мазок недостаточно контактировал со спиртом, т.е. не обесцветились тонкостенные бактерии. В итоге все остались фиолетовыми.
2. Все бактерии в итоге грамотрицательные. Если опять отмести возможность присутствия только действительно грамотрицательных бактерий, то ошибка заключается в обратном. Т.е. в переобесцвечивании спиртом. В итоге все обесцвечиваются, и все перекрашиваются в красный цвет. Поэтому при нанесении спирта очень важно соблюдать время контакта с мазком.
3. Отсутствие бактерий в мазке. Это из-за неправильного забора материала, или неправильной фиксации материала (все бактерии смываются при первой же отмывке).
4. Мазок не побурел при нанесении раствора Люголя. Причина – испорченный раствор. Раствор Люголя предпочтительно хранить в стеклянной емкости, из пластиковой емкости со временем йод улетучивается, а сам раствор становится светло-коричневым. Как итог – все бакетрии могут получиться грамотрицательными.
5. Большие фиолетовые образования правильной круглой формы, видимые в микроскоп. Это не кокки – это несмытые капельки генцианового фиолетового после некачественной промывки спиртом.
6. Бактерии в виде объемных нагромождений. Причина в недостаточном распределении бактерий по стеклу на начальном этапе. Мазок нужно равномерно распределять тонким слоем.
7. Другие ошибки. Это может быть несоблюдение времени окраски (недокрашивание, перекрашивание), несоответствие концентрации спирта, чрезмерная тепловая фиксация мазка и т.п.
Небольшие хитрости в вопросах-ответах.
Можно ли использовать аптечный раствор Люголя? Нет! Он другого состава.
Можно ли использовать аптечный этиловый спирт? Да. Но главное чтобы был без добавок типа хлоргексидина, муравьиной кислоты и т.п.
А водку вместо спирта? Нет, в ней недостаточная концентрация спирта, надо 70%.
Можно ли заменить этиловый спирт на изопропиловый? При необходимости можно. Но немного сократить время контакта с мазком.
Можно ли использовать химическую фиксацию вместо тепловой? Да, но это немного сложнее. (Об этом в другой статье).
Как использовать мазок многократно? Очень удачный препарат можно еще несколько раз в дальнейшем просматривать, не смотря на то, что на мазке находится иммерсионное масло. Удалить его никак не получится. Но можно стекло с мазком защитить от пыли помещением в футляр. А в дальнейшем наносить новую каплю масла и вновь микроскопировать.
Подводя итог сказанному, главное – придерживаться методики. Методика сама по себе не строгая, но ошибки на начальных этапах случаются. После нескольких окрашиваний всегда можно понять недочеты и в дальнейшем их легко предотвращать, получая очень красивые и качественные результаты.
Источник
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 16 июля 2019;
проверки требуют 4 правки.
У этого термина существуют и другие значения, см. Метод (значения).
Метод Грама — метод окраски микроорганизмов для исследования, позволяющий дифференцировать бактерии по биохимическим свойствам их клеточной стенки. Предложен в 1884 году датским врачом Гансом Кристианом Грамом.
По Граму бактерии окрашивают анилиновыми красителями — генциановым или метиловым фиолетовым и др., затем краситель фиксируют раствором иода. При последующем промывании окрашенного препарата спиртом те виды бактерий, которые оказываются прочно окрашенными в синий цвет и имеющие толстую клеточную стенку, называют грамположительными бактериями, обозначаются Грам (+), — в отличие от грамотрицательных (тонкая клеточная стенка), Грам (−), которые при промывке обесцвечиваются.
После промывания растворителем при окрашивании по Граму добавляется контрастный красный краситель, который окрашивает все грамотрицательные бактерии в красный или розовый цвет. Это происходит из-за наличия внешней мембраны, препятствующей проникновению красителя внутрь клетки. Тест классифицирует бактерии, разделяя их на две группы относительно строения их клеточной стенки.
Использование в диагностике[править | править код]
Окраска по Граму имеет большое значение в систематике бактерий, а также для микробиологической диагностики инфекционных заболеваний.
Грамположительны кокковые (кроме представителей рода Neisseria) и спороносные (за исключением Coxiella burnetii) формы бактерий, они окрашиваются в сине-чёрный (тёмно-синий) цвет.
Грамотрицательны многие неспороносные бактерии, они окрашиваются в красный или розовый цвет.
Техника проведения окраски[править | править код]
Окраска по Граму относится к сложному способу окраски, когда на мазок воздействуют двумя красителями, из которых один является основны́м, а другой — дополнительным. Кроме красящих веществ при сложных способах окраски применяют обесцвечивающие вещества: спирт, кислоты и др.
Для окраски по Граму чаще используют анилиновые красители трифенилметановой группы: генциановый, метиловый фиолетовый или кристаллвиолет. Грамположительные микроорганизмы дают прочное соединение с указанными красителями и йодом. При этом они не обесцвечиваются при воздействии на них спиртом, вследствие чего при дополнительной окраске фуксином грамположительные микроорганизмы не изменяют первоначально принятый фиолетовый цвет.
Грамотрицательные микроорганизмы образуют с основными красителями и иодом легко разрушающееся под действием спирта соединение. В результате микробы обесцвечиваются, а затем окрашиваются фуксином, приобретая красный цвет.
Подготовка материала для окраски[править | править код]
- Исследуемый материал распределяют тонким слоем по поверхности хорошо обезжиренного предметного стекла.
- Приготовленный мазок высушивают на воздухе и после полного высыхания фиксируют.
- Гистологические срезы готовят по стандартной методике, фиксируя кусочки тканей в формалине и заливая в парафин.
Фиксация[править | править код]
При фиксировании мазок закрепляется на поверхности предметного стекла, и поэтому при последующей окраске препарата микробные клетки не смываются. Кроме того, убитые микробные клетки окрашиваются лучше, чем живые.
Различают физический способ фиксации, в основу которого положено воздействие высокой температуры на микробную клетку, и химические способы, предусматривающие применение химических средств, вызывающих коагуляцию белков цитоплазмы.
Физический способ фиксации[править | править код]
Предметное стекло с препаратом берут пинцетом или I и II пальцами правой руки за рёбра мазком кверху и плавным движением проводят 2—3 раза над верхней частью пламени горелки. Весь процесс фиксации должен занимать не более 2 с.
Надёжность фиксации проверяют следующим приёмом: свободную от мазка поверхность предметного стекла прикладывают к тыльной поверхности левой кисти. При правильном фиксировании мазка стекло должно быть горячим, но не вызывать ощущения ожога (70—80°C).
Химический способ фиксации[править | править код]
Для фиксации мазков применяют метиловый спирт, ацетон, смесь Никифорова (смесь этилового спирта 96 % и наркозного эфира в соотношении 1:1), жидкость Карнуа (96-процентного этилового спирта — 60 %, хлороформа — 30 %, ледяной уксусной кислоты — 10 %), спирт-формол (40-процентного формалина — 5 мл, 96-процентного этилового спирта — 95 мл). Предметное стекло с высушенным мазком погружают в склянку с фиксирующим веществом на 10—15 минут и затем высушивают на воздухе. Применяется также фиксация в парах 40-процентного формалина в течение нескольких секунд.
Процесс окрашивания мазков[править | править код]
- На фиксированный мазок наливают один из осно́вных красителей на 2—3 минуты. Во избежание осадков окрашивают через фильтровальную бумагу.
- Сливают краску, аккуратно удаляют фильтровальную бумагу. Мазок заливают раствором Люголя или йодистым раствором по Граму (водный раствор йодида калия и кристаллического йода в соотношении 2:1) на 1—2 минуты до почернения препарата.
- Раствор сливают, мазок прополаскивают 96° этиловым спиртом или ацетоном, наливая и сливая его, пока мазок не обесцветится и стекающая жидкость не станет чистой (приблизительно 20—40—60 секунд).
- Тщательно промывают стекла в проточной или дистиллированной воде 1—2 мин.
- Для выявления грамотрицательной группы бактерий препараты дополнительно окрашивают фуксином или сафранином (2—5 мин).
- Промывают в проточной воде и высушивают фильтровальной бумагой.
Техника окраски бактерий в гистологических срезах по Граму-Вейгерту[править | править код]
- Депарафинированные срезы доводят до воды.
- Окрашивают 20 мин в 1 % растворе парарозанилина или основного фуксина в 1 % уксусной кислоте (раствор красителя нагревают до кипения, охлаждают и фильтруют).
- Промывают в 3 сменах дистиллированной воды.
- Окрашивают 5 мин в 1 % кристаллического фиолетового в дистиллированной воде.
- Быстро ополаскивают в 1 % растворе хлорида натрия.
- Обрабатывают 30 с в смеси: 1 часть иода + 2 части йодида калия + 100 частей дистиллированной воды.
- Промокают фильтровальной бумагой.
- Дифференцируют, нанося на срез смесь равных объёмов анилина и ксилола (1 — 2 мл); растворы сливают до тех пор, пока облачка красителя не перестанут отходить от среза.
- Проводят через 3 смены ксилола.
- Заключают в бальзам или любую смолу, растворённую в ксилоле.
Результат: грамположительные бактерии — сине-чёрные, фибрин — фиолетовый, ядра — красные.
См. также[править | править код]
- Окраска микроорганизмов
- Анилиновые красители
Литература[править | править код]
- Грама метод // Гоголь — Дебит. — М. : Советская энциклопедия, 1972. — (Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров ; 1969—1978, т. 7).
На немецком языке
- Gram, HC (англ.)русск.. Über die isolierte Färbung der Schizomyceten in Schnitt- und Trockenpräparaten (нем.) // Fortschritte der Medizin : magazin. — 1884. — Bd. 2. — S. 185—189.
На английском языке
- Bergey, David H.; John G. Holt; Noel R. Krieg; Peter H.A. Sneath. Bergey’s Manual of Determinative Bacteriology (англ.). — 9th ed.. — Lippincott Williams & Wilkins (англ.)русск., 1994.
- Madigan, MT; Martinko J; Parker J. Brock Biology of Microorganisms (неопр.). — 10th Edition. — Lippincott Williams & Wilkins (англ.)русск., 2004.
- Ryan, KJ; Ray, C. G. Sherris Medical Microbiology (неопр.). — 4th ed.. — McGraw Hill., 2004.
- Application of stains in clinical microbiology // Biotechnic & Histochemistry, Volume 76, Number 3, May 01, 2001, pp. 119—125(7)
Источник
Окрашивание по Граму широко распространено в микробиологии, так как это один из самых простых способов дифференциации бактерий в зависимости от состава их клеточной стенки. По Граму все бактерии можно разделить на грамположительные (Грам(+)) и грамотрицательные (Грам(-)). Метод окрашивания по Граму был разработан в 1884 году, и с того времени не утратил популярности, хотя и неоднократно модифицировался.

Структура клеточной стенки
Окрашивание по Граму позволяет выявить, к грамположительным или грамотрицательным относится та или иная бактерия. Деление бактерий на Грам(+) и Грам(-) осуществляется в соответствие со строением их клеточной стенки.
Клеточная стенка в наибольшем количестве содержит пептидогликан (муреин) – сложное вещество, в состав которого входят пептапептид и гликан. Гликан состоит из чередующихся остатков N-ацетилглюкозамина и N-ацетилмурамовой кислоты, соединенных друг с другом β-1,4-гликозидными связями. Пептидогликан обеспечивает поддержание формы клетки, осмотическую защиту, а также антигенные функции.
Основные различия грамположительных и грамотрицательных бактерий
У различных бактерий толщина слоя пептидогликана не одинакова. У бактерий, которые относят к грамположительным, она составляет от 15 до 80 нм, в то время как у грамотрицательных – от 2 до 8 нм. В то же время у грамотрицательных бактерий под слоем пептидогликана есть особая структура, которой нет у грамположительных бактерий – периплазматическое пространство. Это пространство заполнено гидролитическими ферментами – β-лактамазой, рибонуклеазой 1, фосфатазой. Именно эти ферменты ответственны за резистентность грамотрицательных бактерий в отношении многих антибиотиков.
Слой пептидогликана Грам(-) бактерий связан с липополисахаридом – антигенной структурой, содержащей эндотоксин. У Грам(+) бактерий похожие функции выполняют тейхоевые кислоты.
У грамотрицательных бактерий присутствует дополнительная структура – внешняя мембрана.
Суть метода окрашивания
Перед тем как начать окрашивание, готовят мазки исследуемых бактерий. Для этого на предметное стекло капают воду и бактериальной петлей добавляют туда культуру микроорганизмов. Затем, после полного высыхания воды, мазок фиксируют – предметное стекло проносят несколько раз над пламенем горелки. Окрашивание мазков по Граму более эффективно, чем окрашивание живых бактерий – с мертвыми клетками лучше связываются молекулы красителя.
Окрашивание производится в несколько этапов:
- На фиксированный мазок накладывают небольшие кусочки фильтровальной бумаги и наливают основной краситель – генцианвиолет или метиленовый синий.
- Спустя 3-5 минут снимают окрашенную фильтровальную бумагу и заливают мазок раствором Люголя на 1 минуту. При этом препарат темнеет.
- Сливают раствор Люголя и обрабатывают мазок чистым этиловым спиртом: капают несколько капель на препарат, спустя 20 секунд сливают. Процедуру повторяют 2-3 раза.
- Промывают стекло с исследуемым препаратом дистиллированной водой.
- Производят дополнительное окрашивание – докрашивают препарат фуксином. Спустя 1-2 минуты краситель смывают.
- После высыхания воды изучают мазок под микроскопом. Грамположительные бактерии будут иметь сине-фиолетовый цвет, грамотрицательные – розовый или красный.

Причины различного характера окрашивания
Как было описано выше, при окрашивании бактерий по Граму грамположительные бактерии окрашиваются в сине-фиолетовый цвет, а грамотрицательные – в красный или розовый. Причина дифференциального окрашивания бактерий по этому методу состоит в том, что после попадания в клетку растворимой формы генцианвиолета краситель переходит в нерастворимую йодную форму. Во время обработки бактерии этиловым спиртом под действием этого неполярного растворителя из мембраны экстрагируются липиды. После этого мембрана становится пористой и больше не является существенным препятствием для вымывания красителя. Однако пептидогликан более устойчив к действию неполярных растворителей, в том числе и спирта. Именно он препятствует вымыванию красителя, поэтому бактерии с толстым муреиновым слоем окрашиваются в сине-фиолетовый цвет (грамположительно), и после обработки спиртом свой цвет не меняют.

Тонкий муреиновый слой грамотрицательных бактерий не может удержать в клетке молекулы красителя, поэтому после действия спирта они становятся бесцветными – окрашиваются грамотрицательно.
После воздействия на мазок фуксином при окрашивании по Граму грамположительные бактерии остаются сине-фиолетовыми, а грамотрицательные приобретают розово-красный оттенок.

Примеры Грам(+) и Грам(-) бактерий
К грамотрицательным относятся цианобактерии, серобактерии, железобактерии, хламидии, риккетсии, уксусные бактерии, многие метилобактерии, тионовые бактерии, арсенитобактерии, карбоксидобактерии.
Грамположительными являются бифидобактерии, многие водные бактерии, стрептококки и стафилококки.
Источник
