Микробные клетки кишечной палочки
Кишечная палочка (эшерихии) в организме человека в норме заселяет весь пищеварительный канал. Выделяют различные штаммы (виды) кишечной палочки, которые выполняют полезные функции в организме. Однако некоторые агрессивные разновидности могут вызвать заболевание у детей и взрослых.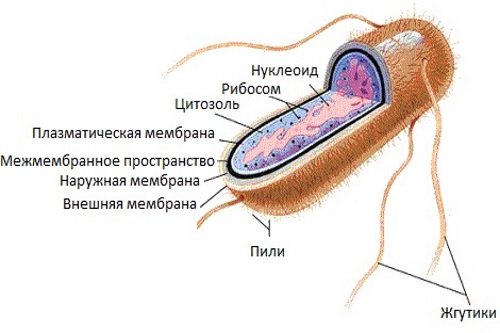
Особенности возбудителя
 Кишечную палочку (эшерихию) новорожденный получает с молоком матери и при непосредственном контакте с окружающими людьми в первые сутки от момента рождения. На протяжении всей жизни определенные штаммы кишечной палочки постоянно присутствуют на поверхности слизистой кишечника, выполняя определенные полезные функции. Это так называемые комменсалы – обязательные представители собственной нормальной микрофлоры кишечника.
Кишечную палочку (эшерихию) новорожденный получает с молоком матери и при непосредственном контакте с окружающими людьми в первые сутки от момента рождения. На протяжении всей жизни определенные штаммы кишечной палочки постоянно присутствуют на поверхности слизистой кишечника, выполняя определенные полезные функции. Это так называемые комменсалы – обязательные представители собственной нормальной микрофлоры кишечника.
При нарушении гигиенических моментов в организм человека проникают патогенные виды кишечной палочки, которые вызывают симптом различных заболеваний.
Непатогенные кишечные палочки
Эшерихии в пищеварительном канале выполняют определенные функции:
- препятствуют заселению слизистой ЖКТ патогенными микроорганизмами (микробный антагонизм);
- участвуют в синтезе витаминов группы В и К;
- обеспечивают процессы расщепления, всасывания и переваривания некоторых пищеварительных веществ.
Большое значение играет не только факт присутствия непатогенных штаммов кишечной палочки внутри пищеварительного канала человека, но и ее количество. При снижении количества эшерихий ниже допустимого уровня отмечается ухудшение всех вышеописанных процессов. При затянувшемся процессе формируется дисбактериоз – нарушение микробного соотношения в пищеварительном канале.
Определить качественный и количественный состав микробной флоры человека в кишечнике в целом и кишечной палочки в частности можно с помощью развернутого бактериологического исследования (так называемый анализ кала на дисбактериоз) и копрограммы.
Патогенные виды кишечной палочки
Среди патогенных штаммов кишечной палочки выделяют:
- энтеропатогенные;
- энтеротоксигенные;
- энтероинвазивные;
- энтерогеморрагические.
Для каждой группы характерна определенная клиническая симптоматика.
Источником инфекции при эшерихиозе может быть как больной человек, так и инфицированное животное. Среди возможных путей передачи на первом месте стоит пищевой, после него контактный и водный.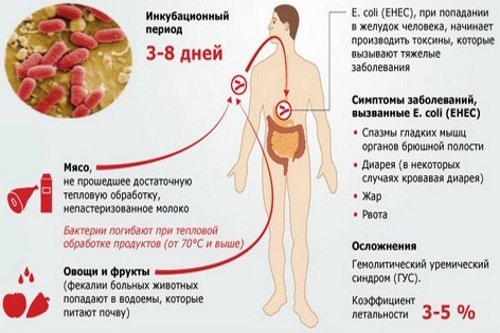
Энтеропатогенные виды кишечной палочки вызывают развитие энтероколитов (поражения тонкой и толстой кишки) у детей раннего возраста (в том числе и первого года жизни). Источником инфекции является взрослый человек (родственники или чаще всего медицинский персонал), наибольшую значимость имеет так называемый носитель. Передача инфекции осуществляется контактно-бытовым путем (через предметы обихода и медицинский инструментарий).
Энтероинвазивные виды кишечной палочки вызывают острые кишечные нарушения у детей более старшего возраста и у взрослых людей. Источником инфекции также является человек, ведущий путь передачи – пищевой. Среди возможных пищевых факторов передачи инфекции наиболее значимы:
- молочные продукты (кефир, ряженка, творог, простокваша);
- разнообразные салаты;
- мясные продукты (студень, холодец);
- напитки, не подвергающиеся термической обработке (квас, компот, соки в нестерильной таре).
Энтеротоксигенные разновидности кишечной палочки вызывают кишечные расстройства у детей дошкольного возраста. Наиболее распространены в странах с тропическим и субтропическим климатом, поэтому рассматриваются как возможный возбудитель так называемой «диареи путешественников». Наиболее характерный путь передачи – водный, так как для развития клинической симптоматики необходимо проникновение в организм человека достаточно большой дозы патогенного варианта кишечной палочки.
Энтерогемолитические разновидности кишечной палочки изучены меньше. Вызывают поражение пищеварительного канала у взрослых людей. Предполагаемый источник инфекции – крупный рогатый скот, а возможные факторы передачи – продукты животного происхождения, не проходящие достаточную термическую обработку (мясо с кровью, непрожаренный шашлык, молоко некипяченое).
 Факторы размножения и роста
Факторы размножения и роста
Размножению и росту бактерий способствует любая погрешность в выполнении санитарно-гигиенических правил:
- недостаточно тщательное мытье рук;
- употребление сырой водопроводной или колодезной воды;
- неправильное мытье посуды, овощей и фруктов (холодной водой, без моющего средства и без щетки);
- редкая смена нательного и постельного белья.
Все это приводит к попаданию кишечной палочки в пищеварительный канал и другие системы органов. Это вызывает развитие нарушений и тяжелых заболеваний репродуктивной и мочевыделительной сферы, а также нервной системы.
Симптомы заболеваний, вызываемых кишечной палочкой
Если патогенная кишечная палочка проникает в пищеварительный канал человека, то наблюдается такая клиническая симптоматика:
- продолжительная тошнота и повторные эпизоды рвоты;
- боль в животе умеренной интенсивности и разлитого характера;
- жидкий стул, иногда с примесью крови и слизи (при поражении инвазивными штаммами);
- ухудшение общего состояния (повышение температуры тела, слабость, снижение аппетита).
При поражении мочевыделительного тракта и репродуктивной сферы клинические проявления неспецифичны: доминирует болевой синдром. Кишечная палочка наиболее опасна, если попадает в кровь или центральную нервную систему. В этом случае развивается заражение крови (сепсис) или менингит (менингоэнцефалит). Развиваются тяжелые нарушения функций внутренних органов, которые могут привести к смерти больного.
Варианты обнаружения бактерии
Присутствие кишечной палочки допустимо только в пищеварительном канале. Можно даже сказать, что эшерихия обязательно должна выделяться из пищеварительного тракта здорового человека.
 В других биологических жидкостях (кровь, моча, вагинальный секрет, мазок из уретры) кишечная палочка отсутствует.
В других биологических жидкостях (кровь, моча, вагинальный секрет, мазок из уретры) кишечная палочка отсутствует.
Если кишечная палочка обнаружена в моче или вагинальном секрете (мазке из уретры), то следует повторить исследование. Вполне возможно, что сбор биологического материала был проведен с нарушениями: недостаточно тщательно помытые руки и половые органы или нестерильный контейнер. Если и при повторном бактериологическом посеве обнаруживается эшерихия, то это свидетельствует о патологическом процессе. Как правило, наблюдаются и другие признаки воспалительных изменений. Лечение необходимо в соответствии с выраженностью клинических проявлений.
Худший вариант – обнаружение кишечной палочки в крови или спинномозговой жидкости. Это признак тяжелой генерализованной инфекции, требующий немедленного комплексного лечения.
Лечение
 Лечение кишечной палочки зависит от локализации патологического процесса. Непосредственное воздействие на патогенный штамм эшерихии оказывают антибиотики и кишечные антисептики, а также бактериофаги. В комплексном лечении диареи, вызванной кишечной палочкой, применяются:
Лечение кишечной палочки зависит от локализации патологического процесса. Непосредственное воздействие на патогенный штамм эшерихии оказывают антибиотики и кишечные антисептики, а также бактериофаги. В комплексном лечении диареи, вызванной кишечной палочкой, применяются:
- средства, усиливающие обратное всасывание жидкости (противопоносные);
- пробиотики или пребиотики;
- ферменты для улучшения переваривания пищи.
Обязательным компонентом лечения эшерихиоза является диетическое питание (стол №4 по Певзнеру) и обильное питье.
Особенностью лечения эшерихиозов является большая его продолжительность – для полного восстановления собственной кишечной микрофлоры потребуется несколько недель. Контроль эффективности терапии проводится с помощью посева каловых масс и копрограммы.
Надежные средства профилактики эшерихиозов в виде вакцины не разработаны. Основной способ предупреждения инфекции – известные всем санитарно-гигиенические мероприятия.
Источник
Инструкция по применению
Показания к применению
Для системного применения: острые аллергические реакции, тяжелый приступ бронхиальной астмы, астматическое состояние, сывороточная болезнь, реакции гиперчувствительности на введение лекарств. неотложные состояния — гипотензия, в т.ч. ортостатическая, коллапс при болезни Аддисона, инфаркт миокарда, геморрагический инсульт, синдром Морганьи-Адамса-Стокса, кома при нарушении мозгового кровообращения и воспалительных заболеваниях мозга, гипотиреоидная и печеночная кома, множественная кровоточивость, острая печеночная недостаточность при отравлениях, отек гортани при аллергических и воспалительных поражениях, ожогах и травмах, отравление витамином D, крепкими кислотами, фосфорорганическими веществами, хинином, хлором, посттрансфузионные осложнения, синдром Мендельсона, укусы змей и скорпионов. анафилактический, геморрагический, кардиогенный и травматический шок. эндокринные заболевания — синдром Уотерхауса-Фридериксена, первичная или вторичная недостаточность коры надпочечников (предпочтительнее природный кортизон и гидрокортизон, синтетические аналоги должны применяться в сочетании с минералокортикоидами), адреногенитальный синдром с потерей натрия, тиреоидит. гиперкальциемия, ассоциированная с раком. ревматические болезни — псориатический, ревматоидный, ювенильный и острый подагрический артрит, анкилозирующий спондилит, острые и подострые бурситы, плечелопаточный периартрит, системная красная волчанка, острый ревматический кардит, дерматомиозит. саркоидоз, синдром Леффлера, бериллиоз, фульминантный или диссеминированный туберкулез легких, аспирационный пневмонит (в сочетании со специфической химиотерапией). идиопатическая тромбоцитопеническая пурпура у взрослых, аутоиммунная гемолитическая и врожденная гипопластическая анемия, эритробластопения, паллиативная терапия лейкемии и лимфом у взрослых, острой лейкемии у детей. нефротический синдром без признаков уремии (для уменьшения протеинурии и индукции диуреза), тяжелые обострения неспецифического язвенного колита и болезни Крона, туберкулезный менингит с субарахноидальным блоком, трихинеллез с неврологическими и миокардиальными проявлениями, острые проявления рассеянного склероза, диссеминированный рак легких (дополнительная терапия), дифференциальная диагностика идиопатической и лекарственно индуцированной лейкопении.Внутрисуставное и периартикулярное введение (гидрокортизона ацетат): реактивный синовит (в т.ч. при деформирующем остеоартрозе), ревматоидный артрит, острые и подострые бурситы, острые подагрические артриты, эпикондилиты, острые неспецифические тендосиновиты, синдром запястного канала, посттравматические остеоартриты. При применении на кожу: воспалительные и аллергические заболевания кожи немикробной этиологии, в т.ч. экзема, дерматит (аллергический, атопический, буллезный герпетиформный, эксфолиативный, себорейный, контактный). зудящие дерматозы, фотодерматозы, аногенитальный зуд, укусы насекомых, пемфигус, эритродермия, псориаз. В офтальмологии (гидрокортизон ацетат в виде глазной мази): аллергический конъюнктивит, блефарит, дерматит век, кератит, восстановление прозрачности роговицы и подавление неоваскуляризации после перенесенных кератитов, химических и термических ожогов (после полной эпителизации роговицы). ирит, иридоциклит, воспаление переднего сегмента, диффузный задний увеит и хориоидит, симпатическая офтальмия, состояние после оперативных вмешательств. В/к при келоидах, локализованных гипертрофических, инфильтративных, воспалительных повреждениях, плоском лишае, псориатических бляшках, кольцевидной гранулеме, нейродермите, дискоидной красной волчанке, диабетическом липоидном некробиозе, гнездной алопеции, кистозных опухолях апоневроза и сухожилий.
Фармакологическое действие
противовоспалительное, противоаллергическое, иммунодепрессивное, противозудное, противошоковое, антиэкссудативное, глюкокортикоидноеТормозит реакции гиперчувствительности, пролиферативные и экссудативные процессы в соединительной ткани, в очаге воспаления. Уменьшает местную гиперемию и гипертермию кожи. Действие опосредовано через специфические внутриклеточные рецепторы. Предотвращает активацию фосфолипазы A2, стимулируя образование ее ингибитора — липомодулина и вследствие прямого воздействия на клеточные мембраны, нарушает синтез ПГ и выделение макрофагального хемотаксического фактора, ингибирует активацию тканевых кининов. Уменьшает миграцию макрофагов и лимфоцитов в очаг воспаления. Блокирует Fc-рецепторы на поверхности макрофагов для IgG и С3 компонента комплемента. Стабилизирует мембраны лизосом, предотвращая выделение лизосомальных ферментов. Подавляет альтерацию, экссудацию и пролиферацию. В больших дозах тормозит развитие лимфоидной и соединительной ткани, угнетает активность гиалуронидазы, уменьшает проницаемость капилляров. Тормозит продукцию коллагеназы и активирует синтез ингибиторов протеаз. Блокирует синтез и высвобождение из сенсибилизированных тучных клеток и базофилов гистамина и других биологически активных веществ, подавляет различные стадии иммуногенеза, не оказывая митостатического действия. Повышает уровень гликогена в печени, тормозит выделение натрия и воды, увеличивает — калия. Влияет на белковый (вызывает отрицательный азотистый баланс за счет повышения катаболизма) и липидный обмены. Увеличивает ОЦК, гидрофильность тканей, повышает АД, оказывает противошоковое действие. Пороговая доза, приводящая к развитию синдрома Кушинга при длительном применении, составляет около 30 мг. При длительном применении развивается атрофия коры надпочечников, угнетается образование АКТГ и тиреотропного гормона гипофиза.Гидрокортизона ацетат характеризуется медленно развивающимся, но более продолжительным, чем у водорастворимых препаратов, эффектом. Используется для введения в места повреждения, суставы и в мягкие ткани, где оказывает местное противовоспалительное действие, хотя возможно развитие системных гормональных эффектов. Лечебный эффект при внутрисуставном введении наступает в течение 6–24 ч и длится от нескольких дней до нескольких недель. Гидрокортизона натрия сукцинат обладает как метаболической, так и противовоспалительной активностью. После в/в введения действие проявляется через 1 ч, продолжительность его варьирует. Экскреция введенной дозы осуществляется в течение 12 ч. При необходимости поддержания высоких плазменных концентраций рекомендуется введение каждые 4–6 ч. Эта соль гидрокортизона быстро абсорбируется и при в/м введении экскретируется также, как и при в/в аппликации.Хорошо всасывается после приема внутрь. Cmax достигается через 1 ч. После в/м введения абсорбция происходит медленно (24–48 ч). Связывается с транскортином плазмы на 70–80%, с альбумином — 10%, около 10% находится в виде свободной фракции. Хорошо проникает через слизистые оболочки и гистогематические барьеры. Метаболизируется в печени. Выводится преимущественно через почки в виде неактивных метаболитов. В плаценте метаболизируется около 70% гидрокортизона с образованием неактивной 11-кетоформы.При применении глазной мази (в виде гидрокортизона ацетата) плохо проникает через роговицу во внутриглазную жидкость, но проникает в эпидермис и эпителий слизистой оболочки. После нанесения на кожу (в виде гидрокортизона ацетата и гидрокортизона 17-бутирата) накапливается в эпидермисе. В небольшой степени может абсорбироваться через кожу и оказывать системное действие. Абсорбировавшаяся часть метаболизируется в эпидермисе и затем — в печени. Метаболиты и незначительная часть гидрокортизона выводится с мочой или желчью.
Противопоказания
Гиперчувствительность (для кратковременного системного применения по жизненным показаниям является единственным противопоказанием).Для системного применения. Системные микозы, паразитарные и инфекционные заболевания вирусной или бактериальной природы (в настоящее время без соответствующей химиотерапии или недавно перенесенные, включая недавний контакт с больным), в т.ч. простой герпес, опоясывающий герпес (виремическая форма), ветряная оспа, корь, амебиаз, стронгилоидоз (установленный или подозреваемый), активный и латентный туберкулез. иммунодефицитные состояния (в т.ч. СПИД или ВИЧ-инфекция), поствакцинальный период, острый психоз, тяжелые формы артериальной гипертонии, декомпенсированный сахарный диабет тяжелого течения. язвенная болезнь желудка и двенадцатиперстной кишки в стадии обострения, дивертикулит. недавнее наложение кишечных анастомозов. пептическая язва. остеопороз, myastenia gravis, болезнь Иценко-Кушинга, тромбофилические состояния, почечная недостаточность, беременность, период лактации.Для внутрисуставного и периартикулярного применения: предшествующая артропластика, состояния после операции наложения кишечного анастомоза, беременность, грудное вскармливание.При применении на кожу: бактериальные, вирусные и грибковые кожные заболевания, кожные проявления сифилиса, туберкулез кожи, опухоли кожи, нарушение целостности кожных покровов (язвы, раны), розацеа, вульгарные угри, периоральный дерматит, поствакцинальный период, беременность, грудное вскармливание.Для глазной мази: гнойные, вирусные, туберкулезные и грибковые заболевания глаз, трахома, первичная глаукома, нарушение целостности эпителия роговицы. период вакцинации, беременность, грудное вскармливание.
Применение при беременности и кормлении грудью
Применение кортикостероидов во время беременности возможно, если ожидаемый эффект терапии превышает потенциальный риск для плода (адекватных и строго контролируемых исследований безопасности применения не проводили). Женщин детородного возраста необходимо предупреждать о потенциальном риске для плода (кортикостероиды проходят через плаценту). Необходимо тщательно наблюдать за новорожденными, чьи матери во время беременности получали кортикостероиды (возможно развитие недостаточности надпочечников у плода и новорожденного). Не следует использовать часто, в больших дозах, на протяжении длительного периода времени.Категория действия на плод по FDA — C.Кормящим женщинам рекомендуется прекратить либо грудное вскармливание, либо применение ЛС, особенно в высоких дозах (кортикостероиды проникают в грудное молоко и могут подавлять рост, выработку эндогенных кортикостероидов и вызывать нежелательные эффекты у новорожденного). При использовании наружных форм гидрокортизона не следует наносить препарат на кожу молочной железы.
Источник
ИНАКТИВИРОВАННАЯ БАКТЕРИАЛЬНАЯ КУЛЬТУРАЛЬНАЯ СУСПЕНЗИЯ E. COLI – ДЕЙСТВУЮЩИЙ КОМПОНЕНТ ФАРМАКОЛОГИЧЕСКИХ ПРЕПАРАТОВ
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Александрова М.А.
1
Радченко В.В.
1
Липкин В.М.
1
1 Учреждение Российской академии наук Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
Обзор посвящён использованию инактивированной бактериальной суспензии клеток бактерии Escherichia coli (БКС E. coli ) в качестве действующего компонента современных фармакологических препаратов. Освещена история вопроса, раскрываются механизмы действия этой группы препаратов через призму современных представлений об иммунитете и развитии воспалительных реакций. Приведён список целевых патологий и анализ опыта лечебного применения. Затронуты особенности биофармацевтического производства и приведены примеры положения некоторых лекарств в этом секторе фармрынка. Обосновывается перспективность разработки отечественных препаратов, имеющих в составе БКС E. coli. Работа может быть полезна для студентов и аспирантов биологических и медицинских специальностей, практикующих врачей и специалистов, занимающихся стратегическим планированием и выводом на российский рынок новых лекарственных препаратов.
воспалительная реакция.
местный иммунитет
иммуномодулирующие препараты
бактериальная культуральная суспензия
1. Besredka A. Antivirus Therapy in Infectious Diseases // Proc R Soc Med. 1929. V. 12. № 12. Р. 1579-1598.
2. Everson M.P., McDuffie D.S., Lemak D.G., Koopman W.J., McGhee J.R., Beagley K.W. Dendritic cells from different tissues induce production of different T cell cytokine profiles // J Leukoc Biol. 1996. V. 59. № 4. P. 494-498.
3. Fesenko E.E., Novoselov V.I., Yanin V.A., Lipkin V.M., Shuvaeva T.M. Antioxidant pharmaceutical compound, method for producing polypeptide and method of cure // United States Patent №US8,003,345 B2. 2011.
4. Galli S.J., Maurer M., Lantz C.S. Mast cells as sentinels of innate immunity // Curr Opin Immunol. 1999. V. 11. P. 53-59.
5. Lane P.J.L., Brocker T. Developmental regulation of dendritic cell function // Curr Opin Immunol. 1999. V. 11. P. 308-313.
6. Posterisan® Posterisan® forte: basic research and clinical efficacy / BCS Ser. Berlin: Dr Kade International, 2001. 87p.
7. Watts T.H., DeBenedette M.A. T-cell co-stimulatory molecules other than CD28 // Curr Opin Immunol. 1999. V. 11. P. 286-293.
8. https://www.cleandex.ru/articles/2010/04/27/Biotechnology_world_market_analize (дата обращения 18.11.2011).
9. https://reports.innovaro.com/reports/dr-kade-pharmazeutische-fabrik-gmbh-strategic-swot-analysis-review (дата обращения 18.11.2011).
Введение
Еще в начале ХХ века Безредка А. М. (французский микробиолог и иммунолог, ученик Мечникова) продемонстрировал, что поверхностно и местно применяемые инактивированные стафилококковые или стрептококковые фильтраты культур были значительно более эффективны в защите животных от последующего введения инфекции в летальной дозе, чем те же самые бактериальные суспензии культур, введенные парентерально (например, внутривенно). Из серии этих экспериментов становилось все более очевидным, что этот тип иммунитета представлялся в значительной степени независимым от формирования антител, т.к. защита животных происходила до истечения 24-часового периода после введения летальной дозы инактивированных нагреванием стафилококков. Кроме того, локальная обработка большей кожной поверхности (даже неповрежденных участков) фильтратом бактериальной культуры часто была достаточна для защиты организма подопытных животных от гибели. В то время результаты этих экспериментов были трудно объяснимы. Сегодня известно, что капсульные липополисахариды могут стимулировать устойчивые независимые Т-лимфоциты, но не длительный иммунитет. Липополисахариды и другие компоненты бактериальных клеток, очевидно, активируют врождённый иммунитет путем усиления фагоцитоза и убийства бактерий, что приводит в дальнейшем к стимуляции приобретённого иммунитета.
Идеи Безредки [1] получили дальнейшее развитие в работах Боннина [6]. Он использовал бактериальную культуральную суспензию (БКС) для лечения воспалительных поражений кожи, геморроя, воспаления анальных покровов и ректальных слизистых мембран. Следующей научной точкой отсчета было создание в 1922 году Боннин совместно с компанией «Др. Каде» (Берлин, Германия) мази (которая в дальнейшем получила коммерческое название «Постеризан»), содержащей бактериальную культуральную суспензию E.coli (БКС E. coli) для лечения геморроя.
Механизм действия бактериальной культуральной суспензии
Сама по себе химическая природа БКС E. coli является «сигналом опасности» для организма. Возможности лечебного воздействия (эффекта ранозаживления и активации механизма регенерации тканей) объясняются следующими причинами:
- Действие БКС E. coli увязывает врождённые и адаптивные пути ответа иммунной системы. Молекулярные компоненты БКС модифицируют различные популяции АПК (антиген-презентирующих клеток) и стимулируют Т-клетки. БКС является неспецифичным антигеном, но может оказывать влияние как на врожденный, так и на специфический иммунные ответы. Причина этого в том, что цитокины, продуцируемые макрофагами, кератиноцитами или дендритными клетками, принципиально антигеннеспецифичны, однако, они могут модифицировать экспрессию множества основных мембранных белков, играющих роль в клеточной коммуникации между АПК, с одной стороны, и Т-клетками, В-клетками или клетками-киллерами, с другой стороны.
- Иммуномодулирующая способность E. coli зависит не только от эндотоксинов, присутствующих в клеточных стенках бактерий. Ряд компонентов, таких как порины, липопротеины, фибриллярные протеины, липид А или липополисахариды, являются сильными индукторами генной экспрессии многих цитокинов в различных типах клеток, включая макрофаги и нейтрофилы – ключевые элементы первой линии антимикробной защиты.
- Дендритные клетки (функционально различные субпопуляции которых присутствуют в разных типах тканей) характеризуются способностью стимулировать Т-лимфоциты, следовательно, способны влиять на итог иммунного ответа, который особенно важен для процессов регенерации [2]. В частности, клетки Лангерганса, находящиеся в коже, представляют собой одни из наиболее специализированных типов клеток, презентирующих антиген отдельным функционально отличным субпопуляциям Т-лимфоцитов [2]. Различные субпопуляции Т-лимфоцитов вовлечены в иммунопатологический, а также иммуннорегуляторный циклы. Поэтому БКС E. coli опосредованно может оказывать влияние на воспалительные процессы, развивающиеся вследствие геморроя и хронического анально-кожного повреждения.
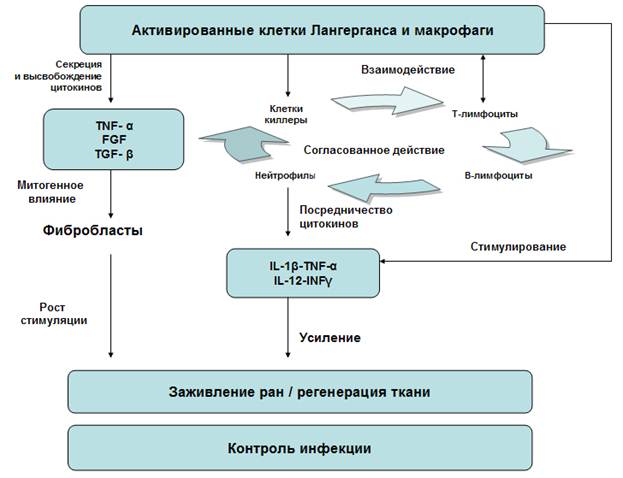
Рисунок. Схема действия бактериальной культуральной суспензии
На современном фармакологическом рынке присутствует целый ряд препаратов, подобных «Постеризану», применяемых как в медицине, так и в ветеринарии. Компания «Др. Каде», имеющая более чем 125-летнюю историю, контролирует более 30 % рынка противогеморроидальных препаратов в Германии, Японии, ряде других стран. Объёмы продаж препаратов фирмы оцениваются в 45-50 млн. евро в год [9]. В России наиболее известны препараты колибактерин, бификол, PRO-SymbioFLOR, эксальб. Включая «Постеризан» и «Постеризан Форте», примерные объёмы продаж препаратов на основе БКС E.coli в нашей стране приближаются к 45-50 млн. евро в год [8]. Стоит отметить, что БКС E. coli является общим действующим компонентом этих препаратов, большинство из которых принадлежит по международной Анатомо-Терапевтически-Химической системе классификации (АТХ) к группе иммуномодуляторов.
В иммуномодулирующем действии препаратов на основе БКС условно можно выделить два основных пути.
Во-первых, бактериальные компоненты БКС могут стимулировать активность АПК и кератиноцитов кожи и за счёт этого повышать цитокиновую секрецию фагоцитов [5] (рис.). Кератиноциты – одни из первых клеток, отвечающие на повреждение тканей (рану) или инфекцию высвобождением медиаторов, участвующих в воспалении. Является общепризнанным, что цитокины, такие, как TNF-α или интерлeйкин-1b, определяют активированный статус T-клеток. В этот процесс вовлечены такие важные костимулирующиеся белки (часто это рецепторы клеток, отвечающие за их взаимодействие и правильное восприятие сигналов), как B7, B7-1 или антигены CD40 [7]. Существуют данные о том, что БКС усиливает эффекты Т-клеточной активации, хотя не является прямым индуктором антиген-специфической активации. Это подтверждается экспериментальными наблюдениями относительно слабого местного ответа антител на БКС, но достаточно серьезного воздействия на медиаторные каскады и локальную (местную) пролиферацию T-лимфоцитов. Целый ряд экспериментов на различных моделях: лимфоузлы кролика, смешанные культуры эпидермальных клеток Лангерганса и очищенных T-клеток (или периферических мононуклеарных клеток крови), подтверждают такой вывод.
Во-вторых, воспаление кожи вызвано накоплением иммунокомпетентных клеток и сопровождается сложными клеточными взаимодействиями между ними и различными медиаторами воспаления. Цитокины и хемокины регулируют связи между клеточными элементами иммунной системы, тогда как липидные медиаторы оказывают влияние непосредственно на секреторную и функциональную активность моноцитов, гранулоцитов, эозинофилов и базофилов, а также неиммунных клеток (тромбоциты, эндотелиальные клетки, тучные клетки, кератиноциты). Скоординированное взаимодействие цитокинов с иммунными клетками может оказывать на последние как стимулирующие, так и ингибирующие действие, которое в результате способно предотвратить повреждение ткани. Так, в процессе заживления раны тканевые макрофаги раны играют не только важную роль в элиминировании остатков повреждённых клеток путем фагоцитоза, но и контролируют уровень факторов роста и цитокинов (см. рис.). Сопутствующее фагоцитозу появление медиаторов (таких, как кислородные радикалы) вносит свой вклад в эффективное и успешное удаление болезнетворных микроорганизмов. Те же свободные радикалы могут воздействовать на регулирование сбалансированного иммунного ответа: чрезмерный синтез и высвобождение хемокинов, цитокинов или липидных медиаторов может вызвать необратимое повреждение ткани путем поддерживания длительной активации местных иммуноцитов и не иммунных клеток. БКС индуцирует синтез лейкотриенов (медиаторы воспаления), гистамина и факторов хемотаксиса (таких, как интерлeйкин-8, IL-8). Например, лейкотриены типа LTB4 быстро привлекают нейтрофилы к воспаленным тканям, стимулируют их миграцию в кожу, вызывают агрегацию тромбоцитов, мобилизуют клеточные запасы кальция, индуцируют выпуск супероксид-радикалов и стимулируют хемотаксис и адгезию эозинофилов при аллергических реакциях кожи. Известно, что воспалительные процессы усиливаются вследствие чрезмерного выпуска этого липидного медиатора тучными клетками, гранулоцитами или моноцитами [4]. IL-8 – самый мощный хемоаттрактант для нейтрофилов и может быть продуцирован эндотелиальными клетками, фибробластами, кератиноцитами и эозинофилами. Высвобождение IL-8 индуцируется при контакте клеток с липополисахаридами. Цитокины TNF-α и интерлeйкин-1b (IL-1b) также способствуют выпуску IL-8. IL-1b и TNF-α далее вызывают активацию эндотелиальных клеток, которая облегчает миграцию нейтрофилов. Понятно, что все эти события порождают воспаление в окружающих тканях, которое в свою очередь может заново активировать миграцию клеток в поврежденную кожу (рис.).
Несмотря на осторожное отношение некоторых специалистов к иммуномодуляторам, в своё время были проведены клинические исследования, доказывающие терапевтические эффекты препаратов на основе БКС E. coli [6] (таблица).
В конце нужно отметить, что поскольку активный компонент этой группы лекарств – суспензия культуры бактерий E. coli, препараты технологичны и выгодны при биотехнологическом производстве. Кроме этого существует возможность значительного улучшения свойств лекарств путём введения в их состав рекомбинантных белков. Фактически это является новым подходом, очевидный плюс которого заключается в отсутствии необходимости очистки препарата рекомбинантного белка перед введением в лекарственную композицию. Подразумевается, что БКС E. coli будет получаться из клеток штамма-продуцента целевого белка, обладающего лечебным действием. Синергизм доказанных иммуномодулирующих свойств БКС и лечебного действия целевого белка очевидно приведёт к увеличению терапевтического эффекта нового препарата. Любое повреждение ткани инициирует события, сопровождающиеся увеличением активных форм кислорода в районе раны, и их нейтрализация в клетке является одним из главных условий быстрого заживления.
Таблица. Результаты клинических исследований двойным слепым методом мазей Постеризан и Постеризан Форте по сравнению с плацебо мазью или активным контролем
Тип исслед. | Кол-во пациентов, возраст | Диагноз | Период лечения | Препарат, доза | Развитие симптомов | Результаты (эф-ть) | Исслед. группа |
Двойное слепое и плацебо | Получившие лечение n=99 плацебо n=102, 44-54 года | Перианальная острая или хрон. экзема с геморроем | 14 дней | мазь Постеризан, 2 г/день перианально | Устойчивое выздоровление | препарат/ плацебо р=0,027 | Heusinger J.F. (1990) |
Двойное слепое и плацебо | Получившие лечение и плацебо n=108, 48-49 лет | Перианальная острая или хрон. экзема с геморроем | 14 дней | мазь Постеризан, 2-3 г/день перианально | Устойчивое выздоровление | препарат/ плацебо р=0,0016 | Heusinger J.F. (1991) |
Двойное слепое и плацебо | Получившие лечение n=66 плацебо n=65, 45-60 лет | Геморрой с зудом и жжением | 14 дней | мазь Постеризан, 2-3 г/день перианально | Уменьшение симптомов | препарат/ плацебо р=0,029 | Heusinger J.F. (1996) |
Двойное слепое и мазь с 0,25% ГК* | Получившие лечение n=87 плацебо n=87, 50-57 лет | Обостренная анальная экземам с воспалением | 14 дней | Постеризан Форте, ГК мазь, 2х2-3 г/день перианально | Уменьшение симптомов | Постеризан Форте знач. лучше ГК мази р=0,0192 | Heusinger J.F. (1994) |
Двойное слепое и мазь с 0,25% ГК | Получившие лечение n=86 плацебо n=86, 47-48 лет | Обостренная анальная экземам с геморроем | 14 дней | Постеризан Форте, ГК мазь, 3х1-2 г/день перианально | Уменьшение симптомов | Постеризан Форте значит. лучше ГК мази р=0,0363 | Heusinger J.F. (1994) |
Двойное слепое и плацебо с и без фенола | Постеризан Форте n=56 плацебо c фенолом n=86 плацебо без фенола n=62, 43-47 лет | Геморрой, анальная экзема, анальные трещины, криптит | 14 дней | Постеризан Форте, 2х1-2 г/день перианально | Уменьшение симптомов | Постеризан Форте статистически значим р=0,005 Равная эф-ть обоих плацебо препаратов | Heusinger J.F. (1996) |
Двойное слепое и актив.контроль (экстракт ромашки) | Получившие лечение n=40 плацебо n=40, 51-54 года | Мокнущая анальная экзема | 14 дней | Постеризан, 3х1г/ден? Связанные материалы © 8 медиков о дисбактериозе |
