Посев воды на кишечную палочку как делать
Санитарно-бактериологическое исследование воды – Ф. К. Черкес
Исследованию подлежит вода:
1) централизованного водоснабжения;
2) из колодцев различного типа;
3) открытых водоемов (рек, озер, морей);
4) плавательных бассейнов;
5) сточных вод.
Примечание. Пробы хлорированной воды берут во флаконы с дехлоратором (гипосульфитом).
Отбор проб воды. Из открытых водоемов воду берут с помощью специальных бутылей или батометров, снабженных грузилами. Пробу воды рекомендуют брать на глубине 10-15 см от поверхности (так как поверхность подвергается воздействию атмосферных факторов) и на расстоянии 1,5 м от берега (вода у самого берега может быть загрязнена микрофлорой почвы).
Для отбора проб водопроводной воды используют стерильные флаконы вместимостью 500 мл, закрытые ватно-марлевыми пробками и покрытые бумажными колпачками.
Кран предварительно обжигают тампоном, смоченным спиртом, после чего воду спускают в течение 10-15 мин и набирают во флаконы. Заполненные флаконы закрывают стерильными пробками.
Примечание. Исследуют 333 мл воды (табл. 54).

Таблица 54. Эмпирическая таблица ГОСТ 16963-73
В распределительной сети водопровода отбор проб воды осуществляют в зависимости от количества населения, проживающего в зоне обслуживания.
Стандартные методы исследования регламентированы для воды центрального водоснабжения (ГОСТ 18963-73) и предусматривают:
1. Определение общего числа микроорганизмов (в 1 мл исследуемой воды должно быть не более 100).
2. Определение коли-индекса и коли-титра (коли-индекс 3, коли-титр 333 и выше; для Москвы и Ленинграда коли-индекс не более 2, а коли-титр более 500).
3. Исследование по эпидемиологическим показаниям на патогенную микрофлору (патогенных микроорганизмов не должно быть обнаружено).
Определение общего числа бактерий
Согласно ГОСТу 18963-73 общее число бактерий – это то количество микроорганизмов, которое содержится в 1 мл исследуемой воды, способных в течение суток при температуре 37° С образовывать колонии, видимые невооруженным глазом (или при увеличении с помощью лупы).
Первый день исследования
При исследовании водопроводной воды засевают 2 чашки. В одну из них вносят 1 мл неразведенной воды, в другую 1 мл воды, разведенной в 10 раз (т. е. 0,1 мл исходной пробы).
При исследовании более загрязненной воды засевают 1 мл воды, разведенной в 100 раз. Это соответствует 0,01 и 1 мл .воды, разведенной в 1000 раз (0,001 мл) и т. д. Для получения таких объемов готовят последовательно десятикратные разведения, по 1 мл каждого разведения вносят в чашку и заливают тонким слоем (12-15 мл) растопленного и остуженного до 45° С питательного агара. Для равномерного распределения исследуемой воды залитые агаром чашки перемешивают путем вращения их. После застывания агара посевы ставят в термостат и инкубируют при температуре 37° С 24 ч.
Второй день исследования
Чашки с посевами вынимают из термостата и подсчитывают число выросших колоний. Учитывают только те чашки, где число колоний находится в пределах 30-300. Если колоний немного, их подсчитывают невооруженным глазом или при помощи лупы.
Если колоний много, то подсчет можно вести с помощью специального прибора для счета микробных колоний (рис. 54).
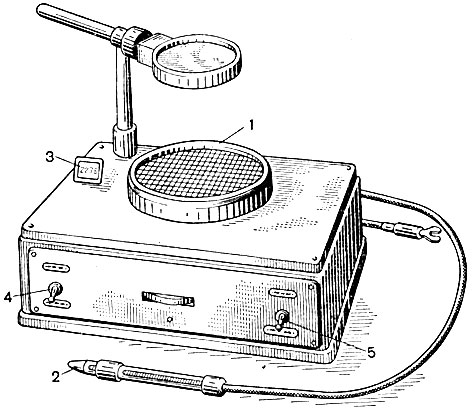
Рис. 54. Прибор для счета колоний микроорганизмов. 1 – столик для чашки Петри; 2 – игла с пружинным устройством; 3 – показатель счетчика; 4 – тумблер для включения импульсного счетчика; 5 – тумблер для включения лампы освещения счетчика
Подсчитанное количество колоний умножают на разведение и узнают число микробов в 1 мл исследуемой воды.
Определение БГКП
Наличие БГКП (бактерий группы кишечной палочки) является показателем фекального загрязнения, интенсивность которого характеризуют:
Коли-индекс – количество кишечных палочек, обнаруженных в 1 л воды.
Коли-титр – наименьшее количество воды, в котором обнаруживают присутствие кишечной палочки*.
* ()
Для выявления в воде БГКП можно пользоваться двумя методами: титрационным (бродильным) и методом мембранных фильтров.
Титрационный метод
Для исследования воды используют среду накопления глюкозопептонную (ГПС) среду Эйкмана с индикатором и бродильными трубками. Среда готовится концентрированной (в 10 раз) и нормальной концентрации – для посева 1 мл воды.
Первый день исследования
Исследуемую воду засевают по 100 мл в 3 колбы, по 10 мл в 3 пробирки (с концентрированной средой) и по 1 мл в 3 пробирки (со средой нормальной концентрации) – всего 333 мл. Посевы инкубируют в термостате при 37° С 24 ч.
Второй день исследования
Вынимают посевы из термостата и просматривают их.
При наличии помутнения в колбах или пробирках из них производят посев петлей на сектора среды Эндо в чашках Петри. Посевы инкубируют в термостате при 37° С.
Третий день исследования
Вынимают чашки из термостата. Из подозрительных колоний делают мазки. При наличии грамотрицательных палочек ставят пробу на оксидазную активность. Положительная проба на оксидазу дает право дать отрицательный ответ.
Проба на оксидазу. 1-й способ: со среды Эндо снимают петлей 2-3 колонии каждого типа и наносят на поверхность фильтровальной бумаги, смоченной диметилпарафенилендиамином. Положительная реакция характеризуется посинением штрихов, сделанных из колоний.
2-й способ: реактив можно нанести на изолированную колонию на среде Эндо (красная колония – синеет) (рис. 55).
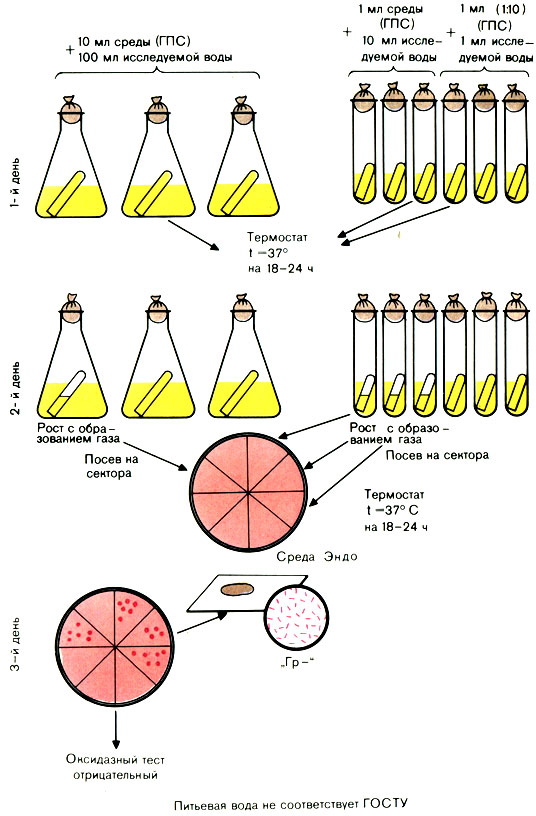
Рис. 55. Определение коли-индекса воды титрационным методом
Отрицательная проба на оксидазу свидетельствует о наличии в воде БГКП. В этом случае вычисляют коли-индекс и коли-титр с помощью стандартных (эмпирических) таблиц ГОСТа 16963-73 (см. табл. 54).
Эти таблицы предусматривают любую возможную комбинацию объемов посева, из которых выделена кишечная палочка.
Метод мембранных фильтров
Для фильтрации воды можно использовать воронку Гольдмана вместимостью 700-800 мл.
Первый день исследования
В воронку смонтированного и простерилизованного фильтровального прибора Зейтца наливают отмеренный объем исследуемой воды. С помощью насоса создают вакуум в приемном сосуде (обычно воду фильтруют через фильтры № 2 и 3). По окончании фильтрации стерильным или обожженным в огне пинцетом снимают фильтр и накладывают его на среду Эндо в чашке Петри так, чтобы поверхность с осевшими на ней микробами была обращена вверх (на одну чашку можно помещать 3-4 мембранных фильтра).
Посевы инкубируют в термостате при температуре 37° С 18-24 ч.
Второй день исследования
Чашки с посевами (фильтрами) вынимают из термостата. Отсутствие подозрительных колоний дает право дать отрицательный ответ.
Учету подлежат все красные и розовые колонии с металлическим блеском или без него. Из выросших колоний делают мазки, окрашивают по Граму (рис. 56).
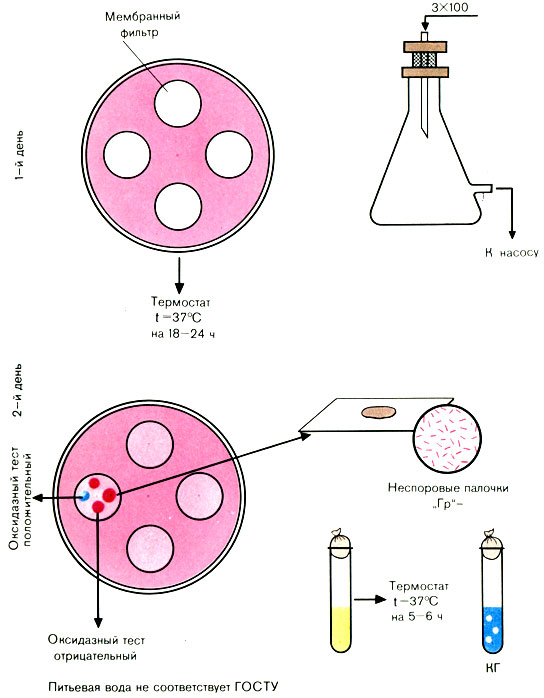
Рис. 56. Определение коли-индекса воды методом мембранных фильтров
При наличии грамотрицательных палочек ставят пробу на оксидазу. Положительная оксидазная проба дает право дать отрицательный ответ. При отрицательной оксидазной пробе производят посев на полужидкую среду с глюкозой и индикатором или на среду ГПС с бродильными трубками – для выявления ферментации углевода до кислоты и газа. При наличии кислоты и газа вычисляют коли-индекс. Например, на всех фильтрах, находящихся на среде Эндо, выросло 3 колонии, пропущено через фильтр было 300 мл воды.
Расчет. 300 мл – 3 колонии
1000 мл – х
х = 10; коли-индекс 10
Примечание. Титрационный метод более точный и может быть использован при наличии в воде примесей. Метод мембранных фильтров экономичнее и дает возможность дать ответ на 2-й день.
Выявление свежего фекального загрязнения
Для определения наличия в воде свежих фекальных кишечных палочек производят посев воды (3-х объемов) на лактозопептонную среду с борной кислотой. Инкубируют при 43° С 24 ч. Наличие кислоты и газа свидетельствует о свежем фекальном загрязнении.
По эпидемиологическим показаниям в воде определяют сальмонеллы, шигеллы, энтеровирусы.
Примечание. Общепринятым дополнительным показателем фекального загрязнения питьевой воды являются энтерококки. При проведении бактериологического исследования определяют все группы энтерококков, хотя санитарное значение имеют преимущественно фекальные стрептококки, обнаружение которых является показателем свежего фекального загрязнения.
Контрольные вопросы
1. Какова основная задача санитарной микробиологии?
2. Что такое санитарно-показательные микроорганизмы?
3. Что такое коли-индекс и коли-титр?
4. Какие Вы знаете методы определения БГКП?
Задание
Определите общее число микробов в исследуемой пробе воды. Среда ГПС (Эйкмана).
Питательные среды
ГПС (Эйкмана) концентрированная. В 1 л воды растворяют 100 г пептона, 50 г хлорида натрия. Нагревают смесь до кипения, фильтруют, прибавляют 100 г глюкозы, устанавливают рН 7,4-7,6 и разливают по 10 мл в колбы вместимостью 250 мл, по 1 мл в 3 пробирки (концентрированной среды) и по 1 мл в 3 пробирки со средой нормальной концентрации (во всех емкостях среду до нужной концентрации доводят стерильной водой).
Примечание. При исследовании особенно загрязненных вод делают большие разведения (например, 10-6, 10-7 и т. д.).
Источник
Что это такое и какие цели исследования?
Бактериологический анализ является одним из способов оценки того, в каком количестве и какие конкретно виды бактерий присутствуют в воде.
 Анализ имеет следующие цели:
Анализ имеет следующие цели:
- определение количества микроорганизмов, присутствующих в воде;
- оценка этого количества;
- выявление конкретных видов бактерий, находящихся в воде;
- проверка воды на наличие опасных для человека микроорганизмов;
- выбор оптимального варианта очистки воды.
Целью исследования является выяснение пригодности воды для конкретных задач (питья, купания).
Виды вод, для которых используют санитарно-бактериологический тест
Исследование на наличие микроорганизмов предусмотрено для следующих видов вод:
- водопроводная;
- из колодцев;
- из закрытых водоемов (прудах, котлованах);
- из рек, в которых предполагается купание людей;
- артезианская (добытые из скважин);
- грунтовые (взятые из подземных верхних слоев земли);
- родниковая;
- сточные.
Регламентирующие документы
Исследование воды на наличие микроорганизмов регламентируется ГОСТами и СанПиНами. Основным документом является ГОСТ 18963-73. В нем зафиксированы способы бактериологического анализа воды, которая используется для питья.
В этом документе прописаны:
- способы отбора проб воды для исследования;
- правила их хранения;
- правила перевозки в лаборатории.
Также в ГОСТе прописана применяемая при теста аппаратура. Указаны используемые реактивы вместе с питательными средами. Подробно прописана подготовка к исследованию, сама процедура анализа.
- Применяется и ГОСТ 24849-2014. В этом стандарте прописаны методики бактериологического исследования воды в полевых условиях.
- Некоторые положения касательно анализа воды на наличие микроорганизмов зафиксированы в ГОСТе Р 51232-98. Там прописаны способы бактериологического исследования воды для питьевых нужд.
- В СанПиН 2.1.4 1074 01 зафиксированы требования касательно качества воды, идущей на питьевые нужды. В документе содержатся нормативы по бактериологическому составу питьевой воды, согласно которым она может считаться безопасной.
На наличие каких бактерий проводится тест?
В процессе анализа вода исследуется на две разновидности микроорганизмов:
- Первая из них – колиформные. Это бактерии, которые принадлежат к разным видам кишечной палочки.
- Вторая разновидность – термотолерантные колиформные микроорганизмы или фекальные бактерии, хорошо размножающиеся при температуре в 43-450С.
Применяемое оборудование
 При исследовании используется такое оборудования:
При исследовании используется такое оборудования:
- банки с широким горлышком;
- стеклянные воронки;
- конусовидные колбы;
- колбы вместе с тубусом;
- стеклянные флаконы;
- лабораторная посуда;
- пипетки;
- цилиндры;
- бактериологические пробирки;
- спиртовки;
- лабораторные стаканы;
- покровные и предметные стекла;
- бактериологические чаши;
- пробирные поплавки;
- электрический автоклав;
- фильтровальные аппараты;
- кристаллизаторы;
- вакуумный насос;
- лабораторные весы.
Для анализа также используется водоструйный насос. Применяется его лабораторный вариант, выполненный из стекла. Используется водяная баня. Обязательным элементом является биологический микроскоп.
Применяются также:
- осветители;
- металлические пеналы;
- сигнальные часы;
- сетчатые пластины;
- увеличительные лупы;
- pH-метры (для измерения кислотности);
- дистилляторы.
Дополнительно используются:
- электрические термостаты, они предназначены для выращивания микроорганизмов при определенной температуре.
- счетный прибор для измерения выращенных колоний бактерий и сушильные шкафы.
Обязательным элементом являются холодильники. Используются как электрические, так и газовые с температурным режимом от 40С до 60С. Могут применяться походные сумки-холодильники, если бактериологический анализ проводится в полевых условиях.
Забор и транспортировка
Для проведения исследования требуется правильно подготовить воду. Ее забор делается по схеме:
-
 Берется только стерильная бутылка.
Берется только стерильная бутылка. - Водопроводный кран, откуда будет делаться забор воды, предварительно обжигается.
- Из крана на протяжении 7-10 минут должна сливаться вода. Только после этого ее можно набирать в стерильную емкость.
- Тара наполовину набирается водой, закрывается пробкой и перевозится в лабораторию. При этом вода при доставке к месту анализа не должна контактировать со стерильной пробкой.
Для исследования подходит только та вода, с момента забора которой прошло не больше 1,5 часа.
Сам анализ проводится по следующему плану:
- Осуществляют подготовку лабораторной посуды и всех материалов. Вся посуда стерилизуется, промывается и тщательно сушится. Стерилизация происходит в сушильном шкафу. Температура внутри него должна быть порядка 160-1650С. Посуда обрабатывается сухим жаром на протяжении часа. Вместо сушильного шкафа может применяться автоклав. В нем температура ниже – порядка 1260С. Обработка длится полчаса.
- Простерилизованную посуду вынимают из шкафа только после того, когда он остынет до температурных значений меньше 600С.
- Обработанную посуду помещают в лабораторные шкафы. Они должны плотно закрываться.
- Готовят стерильную воду. Сначала исследуемая вода разливается по флаконам, которые закрываются пробками. После этого флаконы с водой стерилизуются в автоклаве в течение 20 минут при температуре 1200С. Такая вода пригодна для использования в течение 2 недель.
- Готовят питательную среду. Ее компонентами может быть как мясной бульон, так и глюкоза, лактоза или фильтрованная желчь скота.
- Готовят химические реактивы для конкретного анализа.
- Подготовленную питательную среду ставят на водяную баню, после чего охлаждают до 45-500С.
- Расставляют стерильные чаши с пометками.
- Берут несколько проб питательной среды и делают два посева в стерильные чаши.
- Колбы со взятой для анализа воды открывают, обжигают их горлышки и немного продувают их воздухом через пипетку. Она должна быть стерильной.
- Чистой палочкой делается забор воды. Она добавляется в стерильные чаши, которые закрываются пробкой.
- Взятая вода заливается остуженным питательным раствором. Чаша со смесью быстро перемешивается вращательными движениями. Далее чаша ставится на ровную поверхность. Смесь внутри нее должна застыть.
- Чаша с застывшим раствором переворачивается вверх дном и ставится в термостат. Там создается оптимальная среда для выращивания посевов (370С). Чаша находится в термостате сутки.
- Чаша с выращенными колониями микроорганизмов кладется на затемненный фон вверх дном. При помощи лупы делается подсчет количества появившихся колоний бактерий. При подсчетах учитывается число микроорганизмов на 1 см3 взятой для анализа воды.
- Результаты фиксируются в протоколе и регистрационном журнале. Дополнительно фиксируются особые условия, при которых проходил анализ.
Стоимость
Примерная цена процедуры для предприятий составляет 6-8 тысяч рублей. Физические лица могут заказать исследования примерно за 2 тысячи рублей.
Бактериологический анализ можно заказать только в специальных лабораторных центрах. У таких организаций обязательно должна быть лицензия (аттестат) и заключение о том, что они имеют все условия для измерений.
Очистка от обнаруженных бактерий
 Очистка воды происходит в несколько этапов. При наличии в ней бактерий применяется хлорирование. Также она очищается путем добавления в нее ионов серебра.
Очистка воды происходит в несколько этапов. При наличии в ней бактерий применяется хлорирование. Также она очищается путем добавления в нее ионов серебра.
Еще одним эффективным методом является угольная сорбция. В воду добавляется активированный уголь, который поглощает опасные примеси.
Также для очистки воды от бактерий применяется ее ультрафиолетовое обеззараживание при помощи ламп и озонирование, в ходе которого вода очищается осушенным воздухом.
Заключение
Бактериологический анализ воды – способ оценки количества и конкретного вида присутствующих в ней бактерий. Основная цель процедуры – оценка качества воды и проверка ее безопасности.
Чаще всего исследуется водопроводная и речная вода, а также вода из колодцев. Если исследование показало наличие бактерий в воде, то ее очищают методами хлорирования, озонирования, угольной сорбции, ультрафиолетового обеззараживания.
А какова Ваша оценка данной статье?
Источник
С целью охраны здоровья населения, для предупреждения желудочно-кишечных инфекций советским санитарным законодательством предусмотрены необходимые мероприятия по содержанию в надлежащем санитарном состоянии источников водоснабжения. Показатели качества воды постоянно действующих водопроводных сооружений и артезианских скважин нормируются Государственным общесоюзным стандартом – ГОСТ 2874-54.
При лабораторно-производственном контроле микробиологическое исследование воды из действующей водопроводной сети и постоянно действующих артезианских скважин должно производиться не реже 1 раза в месяц. Использование новых скважин допускается в тех случаях, когда коли-титр воды укладывается в нормы, допускаемые ГОСТом. Анализ воды таких скважин в первый год их эксплуатации проводят чаще.
Порядок отбора проб
Для выполнения микробиологического анализа воды бактериологическая лаборатория должна иметь запас стерильной посуды: бутылки емкостью 0,5 л, пипетки на 100, 10 и 1 мл, мерные цилиндры и чашки Петри. Тщательно вымытые и высушенные бутылки закрывают ватными пробками, накрывают бумажными колпачками и завязывают шпагатом или толстыми нитками. Помещают бутылки в бумажные пакеты и стерилизуют в сушильном шкафу при температуре 160 °С в течение 1 ч или в автоклаве при 120°С в течение 30 мин. При стерилизации бутылок с притертыми пробками бутылки и пробки стерилизуют отдельно: бутылки перед стерилизацией плотно закрывают ватной пробкой, а для стеклянной пробки делают небольшой пакетик из бумаги и привязывают ее к горлышку бутылки.
Пробу воды для исследования на фекальное загрязнение отбирают в количестве 0,5 л. При исследовании нескольких скважин или колодцев пробы отбирают от каждого объекта отдельно в часы наибольшего расхода воды. Из вновь сооруженной скважины или колодца при отсутствии постоянного отлива воды пробы отбирают после предварительной откачки воды в течение не менее 12 ч.
Отбор пробы воды из водопроводного крана производят следующим образом. Водопроводный кран обжигают в пламени горящего ватного тампона, смоченного спиртом. Затем кран открывают на 10-15 мин, давая воде стечь. Бутылку вынимают из пакета, развязывают бумажный колпачок, вынимают пробку, захватив ее между ладонью и двумя последними пальцами правой руки, и держат ее, стараясь не загрязнить. Подставляют бутылку под струю воды так, чтобы не замочить ее снаружи и не замочить пробку. Наполнив бутылку водой, закрывают ее пробкой над пламенем горелки, завязывают колпачок и делают запись для данной пробы: откуда взята проба, дата и час отбора пробы, цель исследования и фамилия лица, производившего отбор пробы.
Вода должна быть исследована тотчас же после взятия пробы, но не позднее 2 ч после ее отбора. При невозможности выполнения этого условия анализ должен быть произведен не позднее чем через 6 ч после отбора пробы при условии сохранения воды при температурах от 1 до 5°С. Пробы следует предохранять от резких толчков, чтобы не замочить пробок. При санитарно-гигиенической оценке воды по действующему ГОСТу 2874-54 исходят из следующих бактериологических показателей: общего количества микробов в воде (микробное число), коли-титра, коли-индекса.
Воду артезианских скважин и водопроводную, поступающую в городскую сеть, анализируют в количествах от 500 до 10 мл, воду открытых водоемов в зависимости от предполагаемой степени загрязнения – до 0,001 мл.
Определение микробного числа, или общей микробиальной обсемененности воды
Под микробным числом воды понимают количество колоний, вырастающих на мясопептонном агаре в чашке Петри из 1 мл исследуемой воды после инкубации посева при 37 °С в течение 24 ч. У питьевой воды микробное число должно быть не более 100. В воде колодцев и открытых водоемов микробное число допускается до 1000.
При микробиологическом исследовании заведомо чистой воды вносят 1 мл ее в стерильную чашку Петри, заливая 15 мл расплавленного и охлажденного до 45°С мясопептонного агара. При исследовании загрязненных вод делают разведение в 10 или в 100 раз и высевают 1 мл соответствующего разведения.
На крышках чашек делают надпись с указанием номера пробы, разведения и даты посева. После инкубации посевов производят подсчет колоний по обычной методике.
Определение показателей фекального загрязнения воды
Показателями фекального загрязнения воды являются коли-титр и коли-индекс. Под титром кишечной палочки (коли-титром) подразумевается наименьшее количество исследуемого материала (воды), выраженное в миллилитрах (или граммах), в котором обнаруживается хотя бы одна кишечная палочка. Для питьевой воды титр кишечной палочки должен быть не ниже 300 (для Москвы и Ленинграда – не ниже 500).
Коли-индекс кишечной палочки – количество особей кишечной палочки, обнаруженное в 1 л жидкости (воды) или в 1 г плотного вещества. Установив коли-титр исследуемого вещества, можно произвести перерасчет на коли-индекс, и наоборот. Для получения коли-индекса нужно разделить 1000 на коли-титр.
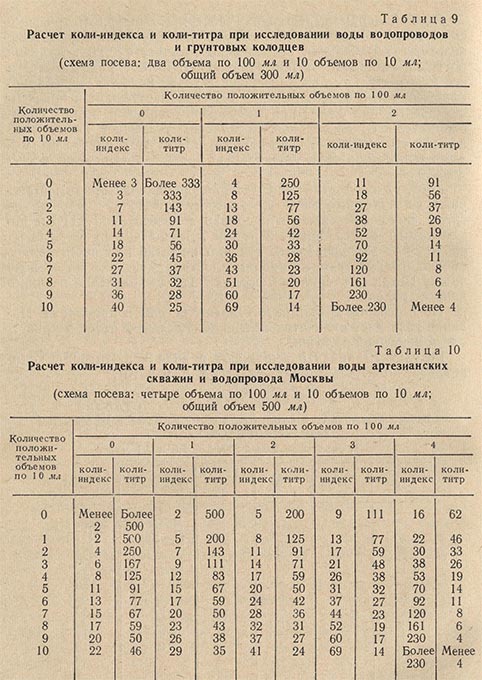
Вода колодцев и открытых водоемов признается доброкачественной при коли-титре не менее 90 и коли-индексе не более 11. Определение коли-титра чаще всего производится трехфазным методом бродильных проб.
1-й этап – первый день (первая бродильная проба). Исследуемую воду засевают (с соблюдением правил стерильности) в бродильные сосуды с глюкозо-пептонной средой (ГПС). Для выявления газообразования в посевах на дно бродильных сосудов перед заполнением их питательной средой предварительно должны быть опущены поплавки – маленькие пробирочки, перевернутые вверх дном (см. стр. 192). В каждый бродильный сосуд помещают по одному поплавку. Во время стерилизации поплавки заполняются средой.
Если микроорганизмы при развитии на данной питательной среде образуют газ, то он, скапливаясь в поплавке, вытесняет из него жидкость и поплавок поднимается над поверхностью среды в пробирке или флаконе.
В зависимости от характера источника для посева берут 300-500 мл исследуемой воды. Посев 300 мл воды производят следующим образом: два объема воды по 100 мл засевают в два флакона с 10 мл концентрированной глюкозо-пептонной среды и 10 объемов воды по 10 мл засевают в 10 пробирок, содержащих по 1 мл ГПС. При посеве 500 мл воды 4 объема засевают во флаконы по 100 мл и 10 объемов по 10 мл в пробирки.
При исследовании сильно загрязненных вод необходимо засевать меньшие объемы воды – от 10 до 0,0001 мл и даже 0,00001 мл (по 1 мл из соответствующих разведений). В этом случае посев производится в пробирки, содержащие по 10 мл разведенной глюкозо-пептонной среды. Посев производят по схеме – четыре десятикратно убывающих объема исследуемой воды, например: 100, 10, 1 и 0,1 или 10, 1, 0,1 и 0,01 мл (в зависимости от предполагаемого загрязнения воды).
Посевы инкубируют 24 ч при 43°С. При возникновении газообразования и помутнения среды бродильные сосуды (флаконы и пробирки) отмечают знаком « + »; при отсутствии газообразования и помутнения – знаком «-».
2-й этап – второй день. Из сосудов с признаками микробного роста (помутнение или помутнение и газообразование) производят высев петлей на среду Эндо в чашки Петри. Засеваемый материал наносят на поверхность среды в виде пересекающихся штрихов или растирают шпателем для получения изолированных колоний. Посевы выращивают при 37 °С в течение 24 ч. Во избежание расплывчатого роста колоний чашки со средой Эндо перед посевом следует слегка подсушить в термостате в течение 30 мин.
По окончании выращивания посевы в чашках Петри просматривают. Отсутствие роста дает окончательный отрицательный ответ: фекальное загрязнение отсутствует. При наличии роста приготовляют мазки, окрашивают их по Граму, исследуя все подозрительные на кишечную палочку колонии – как ярко-красные, так и бесцветные или с розовым оттенком и красным центром. Обнаружение при микроскопировании в мазках грамотрицательных неспороносных палочек указывает на возможное наличие бактерий кишечной группы. В этом случае необходимо провести вторую бродильную пробу – третий этап исследования.
3-й этап – третий день (вторая бродильная проба). Материал из подозрительных на кишечную палочку колоний со среды Эндо пересевают в пробирки с разведенной ГПС и поплавками и выдерживают 24 ч при температуре 43°С. Если на среде Эндо изолированных колоний не было или наблюдалась смешанная культура, необходимо повторить пересев на свежую чашку Петри со стерильной средой Эндо до получения изолированных колоний.
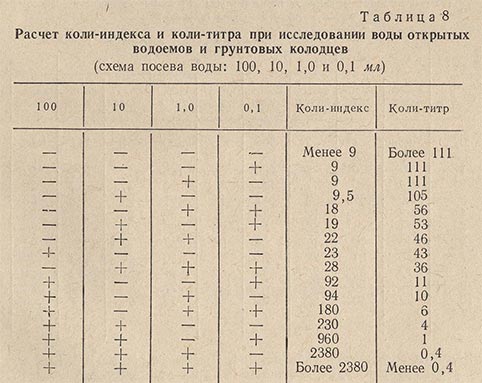
По истечении 24 ч просматривают посевы в пробирках. Наличие газа дает окончательный положительный ответ о присутствии кишечной палочки. Результаты анализа выражают в виде коли-титра и коли-индекса, пользуясь таблицами (табл. 8, 9 и 10).
При исследовании водопроводной воды предпочтительнее производить определение коли-индекса путем посева воды на мембранные фильтры (рис. 82). Этот метод позволяет концентрировать микрофлору, содержащуюся в значительном объеме воды, на небольшом участке поверхности плотной питательной среды.
Исследование воды на фекальное загрязнение методом мембранных ультрафильтров в последние годы получило довольно широкое распространение в бактериологических лабораториях благодаря следующим преимуществам:
1) срок анализа сокращается до 24 ч, что значительно экономит время;
2) экономятся среды;
3) обнаруживаются самые незначительные количества микробов в воде;
4) проводится прямой и достаточно точный подсчет количества колоний;
5) метод позволяет выделить каждый микроб в чистой культуре.
Мембранные фильтры (ультрафильтры) – это пористые нитроцеллюлозные пленки, которые выпускаются в виде кружков диаметром 35 мм и толщиной 0,1 мм с различным диаметром пор. Для исследования воды применяют фильтры № 3. В сухом виде мембранные фильтры пригодны к использованию в течение одного года. Для более продолжительного хранения их помещают в герметически закрытую склянку с притертой пробкой, в которую наливают 30%-ный водный раствор спирта.
Техника выполнения анализа следующая:
1-й день. Мембранные фильтры перед употреблением помещают в стакан с дистиллированной водой, подогревают воду до 50-60°С, меняя ее 2-3 раза. Затем снова наливают чистую дистиллированную воду и кипятят 20-30 мин до полного удаления воздуха и органических примесей (растворителей), применявшихся при изготовлении ультрафильтров.
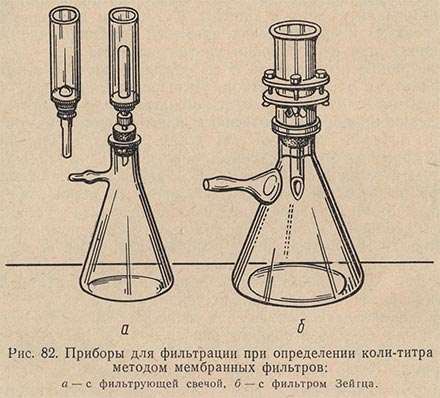
Фильтрацию исследуемой воды осуществляют на металлических фильтрах Зейтца с сеткой. Непосредственно перед фильтрованием металлические фильтры обжигают или кипятят. После охлаждения прибора в него укладывают на сетку мембранный фильтр матовой поверхностью вверх. Укладывание фильтра нужно производить осторожно обожженным и охлажденным пинцетом с гладкими краями. Во избежание повреждения фильтра на него накладывают кружочки стерильной фильтровальной бумаги, предварительно смоченные стерильной дистиллированной водой. На фильтре закрепляют воронку и приступают к фильтрованию отобранной пробы исследуемой воды. Объемы воды, подлежащие фильтрации, варьируют от 300 до 500 мл в зависимости от общей предполагаемой характеристики источника водоснабжения.
При анализе загрязненных вод следует производить фильтрование после предварительного разведения: в 100 мл стерильной воды вводят 1 мл исследуемой пробы и приступают к фильтрации после тщательного перемешивания. Для фильтрации прибор необходимо подсоединить к водоструйному или вакуумному насосу. Вакуум в колбе Бунзена должен быть не менее 0,5 ат (4,9 * 10000 н/м2).
По окончании фильтрации снимают воронку с прибора, фильтр захватывают обожженным пинцетом и накладывают на поверхность среды Эндо в чашки Петри. Чашки помещают в термостат при 37 °С на 24 ч.
2-й день. Через 24 ч инкубации посевы просматривают и выявляют на поверхности фильтров колонии, типичные для группы кишечной палочки: ярко-красные колонии с металлическим блеском – колонии Е. coli commune; слабо-розовые или бесцветные без блеска, выпуклые, слизистые – колонии Е. paracoli. Подсчет колоний производят при помощи лупы.
Из колоний, характерных для кишечной группы, делают мазки и окрашивают по Граму. При обнаружении в мазках грамотрицательных палочек материал из этих колоний пересевают в пробирки с разведенной глюкозо-пептонной средой. Посевы помещают в термостат при 43 °С на 24 ч.
3-й день. После инкубации посевы просматривают и отмечают наличие или отсутствие газообразования. Газообразование свидетельствует о наличии кишечной палочки и наоборот. Расчет коли-титра и коли-индекса производится следующим образом.
Источник
