Послеоперационный период у больных с острой кишечной непроходимостью
Послеоперационная кишечная непроходимость после брюшнополостных операций наблюдается у 0,09- 1,6% больных, а среди осложнений, по поводу которых производится релапаротомпя, составляет 11,3-14,3%. Летальность непроходимости кишечника в раннем послеоперационном периоде колеблется от 16,2 до 52,1%, а в позднем – от 6 до 18% [ Житнюк Р. И., 1976; Родионов В. В. и др., 1981; Сачек М. Г., Аничкин В. В.. 1987].
Классификация (О.Б.Милонов, 2001):
ü
Ранняя непроходимость кишечника функционального или механического характера – возникает в раннем послеоперационном периоде до выписки больного из стационара – образование спаек происходит в период организации фибрина в течение 18-21 суток
•поздняя послеоперационную непроходимость кишечника.
Поздняя послеоперационная непроходимость всегда механическая, возникает после выписки больного из стационара, часто через несколько месяцев и даже лет после операции. ввиду новых топографоанатомических взаимоотношений органов, возникающих после операции, создаются условия для заворота, узлообразования, инвагинации и ущемления кишечных петель.
Функциональная, или паралитическая, кишечная непроходимость обычно возникает в течение 5-6 суток послеоперационного периода, причины ее:
q вялотекущий перитонит
o
q чрезмерная травматизация органов брюшной полости
q большие по объему или технически сложные операции (сопровождающиеся массивной травматизацией брюшинного покрова органов брюшной полости и резекцией тонкой или толстой кишки, реконструктивные операции на желудке, желчных путях, толстой кишке, операции на печени и пищеводе, расширенные онкологические операции, повторные операции на органах брюшной полости и т. д).
q забрюшинные гематомы при травмах
Причины ранней механической послеоперационной непроходимости:
vСпайки брюшной полости, образующиеся вследствие воспалительного процесса или механического повреждения серозного покрова брюшины
vТехнические ошибки хирургов: оставленные в брюшной полости инородные тела, прошивание задней стенки анастомоза, стенозирование выходного отдела желудка после ушивания перфоративных язв, заворот петли кишки вокруг трубчатого дренажа и т. д.
vНепроходимость анастомоза вследствие анастомозита, сдавление петли кишки воспалительным инфильтратом, ущемление внутренней грыжи или ущемление кишки в дефекте апоневроза при подкожной эвентрации и т. д.
Патогенез паралитической непроходимости кишечника:
Возникающая дисфункция вегетативной нервной системы повышает поток импульсов к мышечной стенке кишки по симпатическим нервам и снижает парасимпатическую импульсацию вследствие рефлекторного влияния при раздражении интерорецепторов внутренних органов, при перитоните, непосредственного поражения центральной нервной системы в результате интоксикации. Торможение моторики кишечника может возникнуть также под влиянием гуморальных факторов и токсичных веществ, непосредственно воздействующих на нервно-мышечный аппарат кишечника, вследствие нарушения микроциркуляции в кишечной стенке и изменений концентрации биологически активных веществ (катехоламины, ацетилхолин. серотонин, стероидные гормоны и т. д.).
Патогенез механической кишечной непроходимости:
Фибрин склеивает органы брюшной полости, в результате морфологических трансформаций превращается в соединительнотканное образование – спайку. В образовании фибрина имеют значение два фактора: травматизация брюшины ивоспалительные процессы в брюшной полости.
Травмирующие агенты:
• руки хирурга
• хирургические инструменты
• химические вещества (спирт, йод, хлорамин и т. д.)
•термические факторы (промывание брюшной полости горячими растворами, диатермия)
• инородные тела (лигатуры, тампоны, тальк, трубчатые дренажи).
Причины, вызывающие воспалительные процессы в брюшной полости:
Ø острые хирургические заболевания брюшной полости, сопровождающиеся перитонитом
Ø травмы живота
Ø продолжительные и травматичные операции
Ø выраженность перитонита – нередко наблюдается интенсивное спайкообразование после, нетравматичных и непродолжительных операций и, наоборот, при наличии несомненных предпосылок спайки не образуются.
Клиника и диагностика
•развивается в первые 2-5 суток послеоперационного периода
•введение обезболивающих и антибактериальных средств
•физиологическая динамическая кишечная непроходимость.
Основные жалобы при ранней послеоперационной непроходимости кишечника – боли в животе, рвота, задержка стула и газов, вздутие живота.
Боли – ранний и постоянный симптом, при развитии ОКН в первые 5-6 суток – постоянные распирающие боли разлитого характера, нередко очень интенсивные. Схваткообразные боли наблюдаются редко.
При развитии ОКН в более поздние сроки на фоне благоприятного течения послеоперационного периода, боли возникают внезапно в любое время суток, чаще имеют схваткообразный характер.
При странгуляционной непроходимости боли после схватки не прекращаются, а при обтурации кишечника могут полностью исчезнуть.
По мере увеличения продолжительности непроходимости интенсивность болей может уменьшиться, с исчезновением перистальтики схватки прекращаются.
Задержка стула и газов – классический признак непроходимости. Однако, в первые часы от момента возникновения осложнения после клизмы и стимуляции кишечника газы и кал могут отходить- дистальный стул, эффект – кратковременный и слабо выраженный.
Икота, жажда, сухость во рту свидетельствуют о тяжелых нарушениях обменных процессов, сопутствующих заболеванию.
При обследовании:
ü Язык сухой, покрыт грязно-серым или коричневым налетом
ü Живот увеличен или равномерно вздут при низкой непроходимости, или за счет выбухания верхних отделов при высокой
ü Отчетливая асимметрия живота, участие в акте дыхания ограничено.
ü У худощавых или истощенных субъектов, наблюдается видимая на глаз перистальтика, при этом на передней брюшной стенке могут контурироваться раздутые петли (симптом Шланге).
ü При пальпации живота – разлитая болезненность
ü При сопутствующих перитонеальных явлениях – незначительная ригидность мышц брюшного пресса и положительный симптом Щеткина-Блюмберга.
ü При перкуссии живота в запущенных случаях – скопление свободной жидкости в отлогих местах
ü При аускультации живота – в первые 2-5 суток послеоперационного периода – ослабленные кишечные шумы, позже – перистальтика обычно усилена, иногда – бурная
ü Шум плеска (симптом Склярова)
ü Необходимо обращать внимание на область паховых и бедренных колец, чтобы не пропустить ущемление грыжи в послеоперационном периоде.
ü При ректальном исследовании – нависание передней стенки прямой кишки. В отличие от тазового гнойника нависание не сопровождается образованием инфильтрата и почти безболезненно
ü Ампула прямой кишки пустая, наружный сфинктер заднего прохода расслаблен (симптом «Обуховской больницы»)
Лабораторные исследования:
ü умеренный лейкоцитоз
ü сдвиг нейтрофильной формулы влево
ü гипохлоремия
ü гипокалиемия
ü гипокальциемия
Диагностическая информативность обзорных рентгенологических исследований брюшной полости ограничена, в сомнительных случаях, проводят контрастное исследование с помощью сульфата бария, который вводят в желудок и кишечник через рот или с помощью зонда.
Сроки проведения контрольных рентгенологических исследований и общее время наблюдения включает:
1) время появления сульфата бария в слепой кишке
2) время полного перехода контрастного вещества из тонкой кишки в толстую
3) время появления бариевой взвеси в сигмовидной и прямой кишке.
В нормальных условиях сульфат бария появляется в слепой кишке через 3-3,5 часа, а его полный переход в толстую кишку наблюдается через 6-7 часов.
Увеличение времени продвижения контрастной массы по желудочно-кишечному тракту свидетельствует о возникшей в раннем послеоперационном периоде непроходимости кишечника.
При динамическом рентгеноконтрастном исследовании (при вертикальном, переднем положении больного) могут быть установлены следующие симптомы механической тонкокишечной непроходимости, возникшей после операции:
1) стойкая задержка сульфата бария в области сужения – видна контрастная взвесь, смешанная с кишечным содержимым, которая заполняет всю кишку, расширенную выше места сужения
2) маятникообразное движение сульфата бария в расширенной петле кишки
3) утолщение (отек) круговых складок, которые отчетливо выявляются вследствие оседания сульфата бария в промежутках между ними
4) трехслойное расположение патологических элементов: верхний слой – горизонтальный уровень жидкости с куполообразным газовым пузырем, расположенным над ним, средний слой – жидкое кишечное содержимое с примесью сульфата бария, нижний слой – скопление бариевой взвеси между отечными круговыми складками
5) при высокой непроходимости через 2-3 часа наблюдается значительное уменьшение количества контрастного вещества в петлях тонкой кишки и увеличение его в желудке – симптом повторного ретроградного контрастирования желудка
6) задержка сульфата бария в желудке и смещение его кверху и вправо, иногда желудок занимает высокое и почти поперечное положение, на большой кривизне можно обнаружить округлые вдавления – следы раздутых петель тонкой кишки.
Важнейший диагностический признак ранней ОКН -отсутствие клинического эффекта от целенаправленных консервативных мероприятий – паранефральная блокада, стимуляция кишечника, постоянное трансназальное дренирование желудка, очистительная или гипертоническая клизма, перидуральная анестезия. Длительность проведения этих мероприятий не должна превышать 5- 6 часов.
Чрезмерное упорство при осуществлении консервативной терапии приводит к потере времени и развитию запущенной кишечной непроходимости со всеми вытекающими из этого печальными последствиями.
В диагностике ранней паралитической кишечной непроходимости помогает принцип дифференцированного подхода к расстройствам моторной функции кишечника (Ю. Л. Шальков, С. Н. Кобландин, 1986) :
I – стадия компенсированных нарушений, соответствует банальному послеоперационному парезу кишечника, клинически проявляется лишь умеренным метеоризмом, ослаблением кишечных шумов, отхождением небольшого количества газов при «спокойном» животе. Длительность послеоперационного пареза 2-3 суток
II – стадия субкомпенсированных нарушений – значительное вздутие живота, появление симптомов перитонизма и интоксикации. Перистальтические шумы почти не прослушиваются, больных беспокоят постоянная отрыжка и тошнота. При рентгенологическом исследовании – выраженный пневматоз, единичные чаши Клойбера, замедленный пассаж бариевой взвеси
III – стадия декомпенсированных нарушений – соответствует истинной функциональной кишечной непроходимости – адинамия кишечника, тяжелая интоксикация, рвота застойным кишечным содержимым. Живот резко вздут, имеются симптомы раздражения брюшины. При рентгенологическом исследовании обнаруживают множественные горизонтальные уровни жидкости в петлях тонкой и толстой кишки;
IV – стадия паралича желудочно-кишечного тракта – характеризует терминальную фазу процесса, клинически выражающуюся в тяжелейших расстройствах всех жизненно важных систем организма больного.
Лечение паралитической кишечной непроходимости – оперативное:
•Предоперационная подготовка в течение 2-4 часов, включающая интенсивную коррекцию нарушений гомеостаза, особенно белкового и электролитного баланса, активную аспирацию застойного содержимого желудка и кишечника
• Операцию производят под общим обезболиванием
• Показана широкая релапаротомия, позволяющая произвести щадящую ревизию кишечника с новокаинизацией брыжейки кишки и адекватную санацию брюшной полости растворами антисептиков и антибиотиков
•Декомпрессионная интубация желудочно-кишечного тракта
Операции по поводу ранней механической кишечной непроходимости должны производить только высококвалифицированные хирурги, имеющие опыт выполнения подобных вмешательств. Нередко возникает чрезвычайно сложная ситуация, когда в связи с наличием массивных сращений, множественных инфильтратов брюшной полости или образовавшихся конгломератов органов приходится выбирать нетипичные, иногда очень травматичные способы восстановления проходимости кишечника.
Характер оперативных вмешательств:
• простое рассечение спаек
• резекция участков кишечника
•резекция анастомоза
• наложение обходных анастомозов
• илеотрансверзостомия, удаление инородного тела, наложение кишечного свища
• при инвагинации осторожно производится дезинвагинация, при омертвении кишечной стенки – резекция инвагината
•при обтурации кишки инородным телом – перемещение его дистальнее, энтеротомия и извлечение его, отверстие в кишке ушивают в поперечном направлении
Принципы операции:
– при значительном несоответствии диаметров отрезков кишки после ее резекции накладывают анастомозы бок в бок; при наличии перитонита и достаточной длине приводящего отдела тонкой кишки (не менее 1,5 м) – выведение концевых стом на переднюю брюшную стенку
– при инфильтрации большого сальника – резекция его
–
— при десерозировании стенки кишки, применяют атравматичную технику – десерозированные поверхности нужно тщательно перитонизировать
– при рубцовой деформации ранее наложенного анастомоза, сдавления воспалительным инфильтратом, проходимость восстанавливается путем наложения обходного соустья между приводящим и отводящим отделами.
В послеоперационном периоде важнейшим мероприятием, позволяющим предотвратить рецидив непроходимости, является максимально раннее восстановление моторики кишечника.
Перитонит
Источник
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Ба М.Р.
2
Негребов М.Г.
1, 2
Александров Л.В.
1, 2
1 Городская клиническая больница № 67 им. Л.А. Ворохобова Департамента здравоохранения г. Москвы
2 ГБОУ ВПО Первый Московский государственный медицинский университет им. И.М. Сеченова Минздрава России
Цель исследования: разработать и патогенетически обосновать оптимальную тактику ведения больных с острой тонкокишечной механической непроходимостью (ОТМН) в послеоперационном периоде. Материал и методы: проанализированы результаты лечения 68 (100%) больных с ОТМН, которым выполнена резекция нежизнеспособного участка кишки в зависимости от степени кишечной непроходимости. Выделены основная (I) группа – 40 (58,8%) больных, которым проводили отмывание тонкой кишки и энтеральное зондовое питание (ЭЗП) в раннем послеоперационном периоде, и контрольная (II) группа — 28 (41,2%) больных, которым динамическую кишечную непроходимость (ДКН) разрешали традиционными способами и осуществляли полное парентеральное питание до разрешения ДКН. Результаты: Сроки разрешения ДКН в I и II группах 30±9,8 и 46,3±13,85 ч соответственно; p
тонкая кишка
странгуляционная кишечная непроходимость
спаечная кишечная непроходимость
ущемлённая грыжа
заворот тонкой кишки
резекция кишки
синдром кишечной недостаточности
энтеральное питание
нутритивная поддержка
1. Ачкасов Е.Е., Пугаев А.В., Мельников П.В., Алекперов С.Ф., Александров Л.В, Посудневский В.И., Волков В.С., Ба М.Р. Инвагинационная тонкокишечная непроходимость, обусловленная метастазами меланомы в тонкой кишке // Хирургия. Журнал им. Н.И. Пирогова. 2013. № 1. С. 83–87.
2. Ба М.Р., Негребов М.Г., Ачкасов Е.Е., Александров Л.В., Андрейчиков А.А. Морфологические изменения тонкой кишки при острой тонкокишечной механической непроходимости. // Материалы конференции молодых ученых «Актуальные аспекты диагностики и лечения в абдоминальной хирургии», г. Москва, 26 июня 2014 г. С. 14–16.
3. Негребов М.Г., Ачкасов Е.Е., Александров Л.В., Ба М.Р. Эволюция подходов к классификационным критериям острой кишечной непроходимости // Хирургическая практика. 2013. № 1. С. 24–29.
4. Попова Т.С., Тамазашвили Т.Ш., Шестопалов А.Е. Синдром кишечной недостаточности в хирургии. М., 1991. 240 с.
5. Пугаев А.В., Ачкасов Е.Е. Обтурационная опухолевая толстокишечная непроходимость. М.: Профиль-2С, 2005. 224 с.
6. Сапин М.Р., Милюков В.Е., Антипов Е.Ю. Патогенетическое обоснование лечебной тактики при острой тонкокишечной непроходимости // Вестник хирургической гастроэнтерологии. 2008. № 1. С. 42–51.
7. Сапин М.Р., Николенко В.Н., Никитюк Д.Б., Чава С.В. Вопросы классификационных закономерностей морфогенеза желез стенок полых внутренних органов // Сеченовский вестник. 2012. № 4. С. 62–71.
8. Юдин А.Б., Демко А.Е., Чуприс В.Г. Ранняя энтеральная терапия у больных, оперированных по поводу спаечной тонкокишечной непроходимости // Военно-медицинский журнал. 2008. № 6. С. 60–61.
9. Bologna Guidelines for Diagnosis and Management of Adhesive Small Bowel Obstruction (ASBO): 2010 Evidence-Based Guidelines of the World Society of Emergency Surgery, World J Emerg Surg. 2011; 6: 5. Published online 2011 January 21. doi: 10.1186/1749-7922-6-5PMCID: PMC3037327
10. Gavin G. Lavery, Paul Glover The metabolic and nutritional response to critical illness // Current opinion in critical care. 2000. № 3. P. 145–148.
Острая тонкокишечная механической непроходимость (ОТМН) — одна из наиболее актуальных проблем среди экстренных хирургических заболеваний. Многообразие этиологических факторов, сложность патогенеза, трудности диагностики отражаются на результатах лечения [1, 3, 6, 7, 8]. Послеоперационная летальность при ОТМН составляет от 6,5 до 9,4%, что определяет научно-практическую значимость изучаемой проблемы [8, 9]. В результате анализа неблагоприятных исходов при хирургическом лечении больных с ОТМН сделаны выводы, что у наибольшего количества умерших в ранние сроки после операции имелись глубокие нарушения обмена, одной из причин которых является синдром энтеральной недостаточности [4, 8].
У больных в послеоперационном периоде происходит мощный выброс стрессовых гормонов – катехоламинов, глюкагона, обладающих выраженным катаболическим действием. Энергетические затраты увеличиваются до 50–150%, что определяет необходимость ранней энтеральной нутритивной поддержки в послеоперационном периоде [10].
Функциональные и морфологические изменения в стенке тонкой кишки на различных этапах развития ОТМН определяют важнейшие осложнения этого тяжелого заболевания и смертельные исходы [4]. Проведено много экспериментальных работ на животных, свидетельствующих о важности микроциркуляции в стенке тонкой кишки для улучшения результатов лечения ОТМН [6]. Многие авторы считают, что микроциркуляторные нарушения наступают раньше клинических и исчезают позже последних [4, 6, 8]. Для улучшения результатов лечения ОТМН существенное значение имеют проведение патогенетической терапии и скорейшее восстановление функции тонкой кишки.
Цель исследования – разработать и патогенетически обосновать оптимальную тактику послеоперационного лечения больных с ОТМН.
Материалы и методы. Клиническое исследование выполнено на 68 (100%) больных с ОТМН, осложненной некрозом кишки, на базе ГКБ № 67 им. Л.А. Ворохобова ДЗ г. Москвы в период 2009–2014 гг. Были обследованы 34 (50%) женщины и 34 (50%) мужчины. Всем больным была выполнена резекция нежизнеспособного участка тонкой кишки. Объем резекции кишки зависел от степени ОТМН на основании ранее проведенных исследований [2], при которых было установлено, что для компенсированной ОТМН оптимальным объемом резекции является 10 см в проксимальном направлении от макроскопических границ некроза и 5 см — в дистальном направлении, при субкомпенсированной ОТМН — 15 см в проксимальном направлении от макроскопических границ некроза и 10 см в дистальном. В условиях декомпенсированной ОТМН объем резекции следует увеличивать до 30 см в проксимальном направлении от макроскопических границ некроза и 15 см — в дистальном. Время с момента начала заболевания до поступления в стационар составило 4,98±3,63 ч. Наиболее частой причиной ОТМН были спайки брюшной полости – 42 (61,8%), на втором месте — ущемление грыж – 24 (35,3%), реже заворот тонкой кишки – 2 (2,9%) пациента. Сопутствующие хронические заболевания были выявлены у 46 (67,6%) пациентов (сердечно-сосудистые заболевания, болезни легких, сахарный диабет 2-го типа, хронический пиелонефрит, мочекаменная болезнь, полинейропатия).
Выделяли 3 степени компенсации кишечной непроходимости (КН): компенсированная, субкомпенсированная, декомпенсированная [5]. Степень КН определяли на основании клинической картины, обзорной рентгенографии брюшной полости в положении стоя, ультразвукового исследования (УЗИ) брюшной полости. Компенсированной считали такую КН, при которой на обзорной рентгенограмме брюшной полости выявляли пневматизацию с единичными уровнями жидкости в тонкой кишке; при УЗИ брюшной полости обнаруживали дилятацию тонкой кишки, в просвете — газ и незначительное количество жидкости, при этом толщина стенки не превышала 4 мм, а моторно-эвакуаторная функция была снижена, но сохранена. К субкомпенсированной относили КН, при которой обнаруживали множественные уровни жидкости с газом в тонкой кишке и складками Керкринга, что отражает отек стенки кишки. Данные рентгеносемиотики подтверждали УЗИ брюшной полости, при котором выявляли не только расширение просвета с жидкостным содержимым, но и отек стенки тонкой кишки (толщина стенки до 7 мм) с двойным контуром и сохраненной моторной функцией кишки в виде маятникообразных движений. Критериями декомпенсированной КН являлись множественные тонкокишечные уровни с локализацией арок во всех отделах брюшной полости; при УЗИ — резкая дилятация тонкой кишки, жидкость и газ во всех проксимальных отделах тонкой кишки, толщина ее стенки >7 мм, моторно-эвакуаторная функция отсутствует.
Операцию выполняли в первый час от поступления после предварительной подготовки – коррекции гемодинамических и водно-электролитных нарушений. Всем пациентам выполнены лапаротомия, интраоперационная декомпрессия кишечника при субкомпенсированной и декомпенсированной ОТМН с помощью зонда Эббота—Мюллера, резекция нежизнеспособного участка тонкой кишки с формированием анастомоза бок в бок двухрядным швом, санация и дренирование брюшной полости.
Для сравнения методов разрешения динамической кишечной непроходимости (ДКН) выделили две группы: основную (I) – 40 (58,8%) больных и контрольную (II) – 28 (41,2%) больных. В I группе после декомпрессии тонкой кишки и устранения ОТСН устанавливали интраоперационно-назоинтестинальный зонд (НИЗ) в тощую кишку для разрешения ДКН и проведения раннего энтерального зондового питания (ЭЗП) в послеоперационном периоде. В 1-е сутки после операции в НИЗ со скоростью 100–150 мл/мин вводили охлажденный до 14–16оС 0,9%-ный раствор NaCl в объеме 1200–1500 мл, что способствовало разрешению ДКН. Критериями разрешения ДКН и восстановления функции кишечника являлись: сокращение объема отделяемого по назогастральному зонду, положительная проба на капельное введение 300 мл подогретого до 35–37⁰С физиологического раствора в тощую кишку под контролем УЗИ, жидкий стул. После устранения ДКН проводили раннее ЭЗП сбалансированными энтеральными смесями с последующим переводом на сипинг и оральное питание.
Во II группе для коррекции водно-электролитных нарушений и белково-энергетической недостаточности до разрешения ДКН проводили полное парентеральное питание, в дальнейшем разрешали пить и переводили на оральное питание.
Статистический анализ полученных результатов проводили с применением статистического пакета StatisticaforWindows v. 7.0, StatSoftInc. При сравнении групп по качественным признакам применяли односторонний точный критерий Фишера. При сравнении по количественным признакам независимых групп применяли критерий Манна—Уитни, по количественным признакам зависимых групп – критерий Вилкоксона. Статистически значимыми считались различия при р<0,05.
Результаты исследования. Выявили, что в I группе было 18 (45%) пациентов с компенсированной, 16 (40%) — с субкомпенсированной и 6 (15%) — с декомпенсированной ОТМН, во II группе было 12 (42,9%) пациентов с компенсированной, 11 (39,2%) — с субкомпенсированной и 5 (17,9%) — с декомпенсированной ОТМН. Провели сравнительный анализ результатов лечения двух групп. При анализе трофического статуса (ТС) на протяжении всего послеоперационного периода выявлено, что к 10-м суткам после операции в I группе отмечается тенденция к повышению сывороточного альбумина, трансферрина и лимфоцитов. Во II группе увеличения этих показателей отмечено не было. В результате проведенного анализа изменений ТС у пациентов с ОТМН видно, что использование раннего отмывания тонкой кишки и коррекция белково-энергетической недостаточности ЭЗП позволяет поддержать и стабилизировать ТС в раннем послеоперационном периоде и препятствовать развитию системной воспалительной реакции (рис. 1–5).
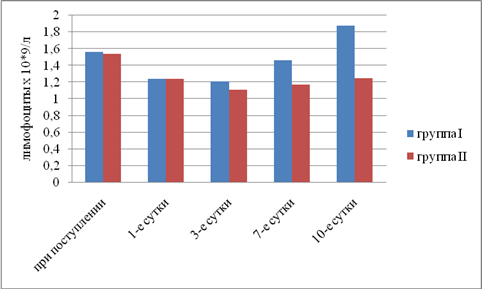
Рис. 1. Динамика изменений абсолютного числа лимфоцитов (р<0,05)
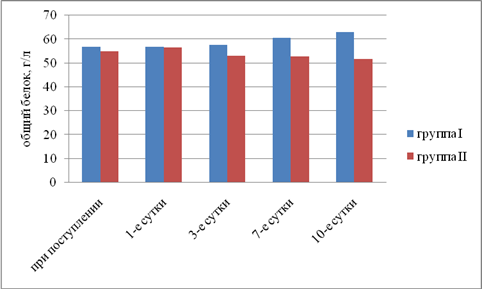
Рис. 2. Динамика изменений общего белка плазмы (р<0,05)
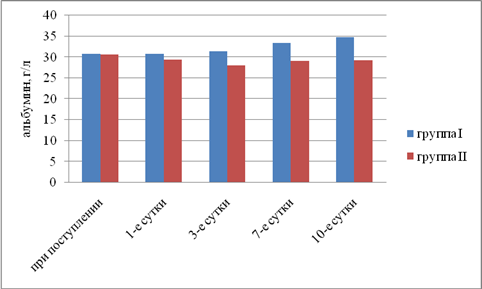
Рис. 3. Динамика изменений сывороточного альбумина (р<0,05)
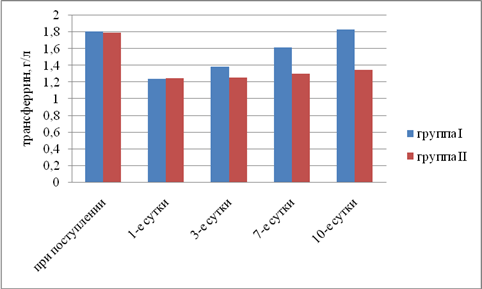
Рис. 4. Динамика изменений трансферрина (р<0,05)
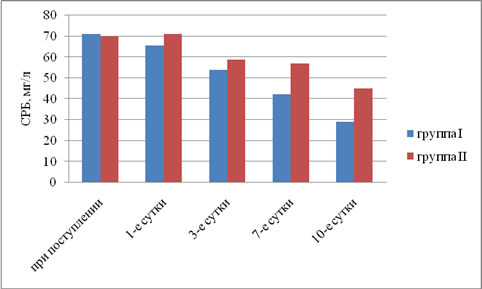
Рис. 5. Динамика изменений С-реактивного белка (р<0,05)
При сравнительном анализе результатов лечения обеих подгрупп выявлено, что во II группе, где отмывание тонкой кишки и раннее ЭЗП не применяли, выше уровень послеоперационных осложнений, больше сроки разрешения ДКН, выше уровень летальности и больше сроки госпитализации (табл. 1).
Таблица 1
Данные о результатах лечения в I и II группах
Показатель | группа I | группа II | Достоверность |
Послеоперационные осложнения | 2 (5,00%) | 9 (32,14%) | р=0,004* |
Сроки разрешения ДКН, ч | 30±9,8 | 46,3±13,85 | p<0,001** |
Сроки госпитализации, сутки | 11,2±1,73 | 14,63±2,24 | р=0,004** |
Летальность | 0 (0%) | 2 (7,14%) | р=0,166* |
Прим.: * Односторонний критерий Фишера; ** Критерий Манна—Уитни
Большую часть осложнений у пациентов II группы составляли гнойно-септические осложнения, что объясняли отсутствием адекватной коррекции белково-энергетической недостаточности в раннем послеоперационном периоде на фоне сопутствующих заболеваний. Выраженные метаболические нарушения, пожилой и старческий возраст, тяжелая хирургическая травма с выраженной катаболической реакцией, длительные сроки госпитализации явились основными причинами развития осложнений.
Заключение. Наиболее оптимальным методом разрешения ДКН в раннем послеоперационном периоде является интраоперационная декомпрессия тонкой кишки с аспирацией кишечного содержимого с последующей установкой назоинтестинального зонда для раннего отмывания тонкой кишки охлажденным до 14–16оС 0,9%-ным раствором NaCl. Отмывание тонкой кишки позволяет сократить объемы инфузионной терапии.
В условиях послеоперационной травмы организма именно кишечник становится основным источником инфекции и источником неконтролируемой транслокации микробов и их токсинов в кровь, что лежит в основе формирующейся системной воспалительной реакции и развивающейся на этом фоне полиорганной недостаточности. В связи с этим назначение больным с ОТМН ЭЗП позволяет минимизировать последствия агрессивного воздействия различных факторов на желудочно-кишечный тракт и сохранять его структурную целостность и полифункциональную активность, что является необходимым условием для более быстрого выздоровления пациента.
Раннее энтеральное питание позволяет предотвратить прогрессирование белково-энергетической недостаточности, снижает частоту послеоперационных осложнений, летальность и длительность пребывания пациентов в стационаре.
Рецензент:
Алекперов С.Ф., д.м.н., заведующий 2-м хирургическим отделением ГКБ № 67 им. Л.А. Ворохобова ДЗ, г. Москва;
Черепанин А.И., д.м.н., заместитель главного врача по хирургии Клинической больницы № 1 МЕДСИ в Отрадном, профессор кафедры госпитальной хирургии № 1 лечебного факультета Первого МГМУ им. И.М. Сеченова, г. Москва.
Библиографическая ссылка
Негребов М.Г., Александров Л.В., Ба М.Р., Негребов М.Г., Александров Л.В. ТАКТИКА ВЕДЕНИЯ ПОСЛЕОПЕРАЦИОННОГО ПЕРИОДА ПРИ ОСТРОЙ ТОНКОКИШЕЧНОЙ МЕХАНИЧЕСКОЙ НЕПРОХОДИМОСТИ // Современные проблемы науки и образования. – 2015. – № 3.;
URL: https://science-education.ru/ru/article/view?id=19679 (дата обращения: 26.08.2020).

Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник
